Функциональные особенности экспрессии генов в Apicomplexa простейшими можно почерпнуть из различных усилий многих лабораторий по разработке векторов экспрессии и модели трансфекции в плазмодии и токсоплазмы (Goonewardene и др, 1993;. Soldati и Бутройда, 1993, Кенгуру и др., 1994;. Ву и др, 1995; Крэбб и скотопромышленник, 1996;. Dechering и др, 1997). Эти эксперименты подтвердили основной принцип monocistrony ранее установленный обкатки на транскрипцию
(Ланзер и др., 1992) и, путем проб и ошибок, показал, что геномные области фланговых паразита ORF, действовать автономно, чтобы придать характерную прочность выражения, а в некоторых ситуациях, специфичность с развитием на endoge-сметке и чужеродные белки кодирующих областей (см, например, Soldati и Бутройда, 1993; Bohne и Roos, 1997). Inaptness элементов промотора млекопитающих, чтобы управлять экспрессией гена в Plasmodium, который был столь же неудачным, когда эксперимент был отменен, был также принцип, установленный этих усилий, которые дали ранний намек на уникальность механизмов тран-scription Apicomplexa (Хоррокса и др., 1998). Эта идея с тех пор подтверждается проблемами для идентификации консервативных факторов транскрипции в Apicomplexa последовательности генома, как описано выше (Коулсон и др., 2004;. Каллебаут и др, 2005; Мейснер и Soldati, 2005). Первоначальные попытки экспрессировать белки в Toxoplasma продемонстрировали наличие регуляторных элементов в геномной последовательности выше по потоку от экзонов, кодирующих SAG1, ROP1 и TUB1 (Soldati и Бутройда, 1993). Фрагменты промотора в этих исследованиях Encom обходили от нескольких сот до нескольких тысяч нуклеотидов-'-flanking геномной последовательности, и отображается дифференциальную прочность (TUB1> ROP1> SAG1). Промотор автономия с тех пор была использована для построения векторов экспрессии содержат-ные геномные последовательности, способны индуцировать экспрессию мРНКа на высоком уровень, с тем, чтобы поднять кодированные уровни белка в Toxoplasma и в связанных с паразитами Neospora сатпит (например, рис 16.2, GRA1 промотора; Хау и др., 1997). Идентичные стратегии были использованы для достижения экспрессии с развитием репортерных генов (Bohne и др., 1997). Конкретное расположение регуляторных элементов в пределах промоторных последовательностей, используемых в этих векторов не часто известно, равно как и сайты инициации транскрипции, как правило, отображенные, оставляя открытой возможность того, что уровни экспрессии, присущие этим фрагментам промотора частично под влиянием пост-транскрипционные механизмы способствовали на 5'-UTR последовательности (Seeber и Boothroyd, 1996). Влияния 3'-UTR регионы, используемые в этих конструкциях, также не полностью проверены; Однако, есть некоторые экспериментальные доказательства

| Транскрипционные CONTROL IN Toxoplasma |
что 3'-UTR последовательность не играет существенную роль в регулировании развития исходов экспрессии (Bohne и Roos, 1997;. Kibe и др, 2005; White, неопубликованный).
Недавно мы разработали систему, использующий вектора рекомбинационного клонирования (Хартли и др., 2000), который основан на принципе Toxoplasma промотора автономии. Основные особенности этой модели состоят из переменной длиной промотора осколочной-ления, который получает с помощью ПЦРА из геномной последовательности с небольшими сайтами рекомбинации (ATT участков), включенные в каждом конце, чтобы обеспечить модульную, рекомбинационную клонированию. Фрагмент затем клонировали 5'- к одному экзона кодирования светлячка или Renilla люциферазы (двойная модель люциферазы хорошо описана в руководстве Promega 058) с помощью recombina-ции (3'-attB2 сайт переводится). В Advan-Tages этой модели лежат в его улучшенной гибкости
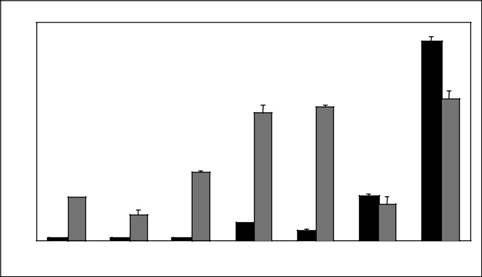
и потенциал для быстрого клонирования нескольких областей промотора. Используя двойную модель люциферазы, мы подтвердили влияние межгенных в регуляции экспрессии генов в процессе Toxoplasma брадизоитных дифференцировок. Четырнадцать 5'-intergenic фланкирующих области от ранее известных генов брадизоитных-и тахизоят конкретный были исследованы на сегодняшний день. Области промотора составил 1-1,5 т.п.н. из 5'-flanking области, присоединенная к люциферазам светлячка посредством рекомбинации клонирования и экспрессии оценивали в формате временной трансфекции, использующий αтубулин-рениллы люциферазы (αванна-RENLUC) управляет Котрансфекция для нормализации различий в эффективности электропорации. Родныеα-tubulin был выбран потому, что уровни мРНК являются относительно неизменного в течение тахизоит дифференциальный-ции в брадизоитном (Dzierszinski и др., 2001). Рисунок 16.2 показывает стресс-индукцию пяти
| увеличение | ||
| складка | ||











SAG4.2-1608LDH2-1510BAG-1195NTPase-1495CW-1500BSR4-2002 GRA6-1500
РИСУНОК 16,2 Двойной тест люциферазы в течение нескольких промоторов Toxoplasma. Фрагменты промотора клонировали в pDEST-FLYLUC-DHFR-3' вектор и трансфицировал в комбинации с αванна-RENLUC (40/20 μг) в VEGmsj паразитов путем электропорации. Паразиты высевали в дублированный Т-25 см2Колбы (2 млн / колба), инкубировали в течение ночи, а затем индуцированные в условиях стресса. Инфицированные монослои Царапины на 48 ч, клетки осаждали и лизаты получают непосредственно без очистки паразита. Последовательные тезы-urement (четыре повтора / конструкт) из светлячка и Renilla люциферазы в каждом экстракте определяли с использованием опубликованных протоколов (ручной 058, Promega Co.). Индуцированные значения в диапазоне от 5000 до 100 000 единиц легких. Кратное увеличениеαуправления ванночка-RENLUC: черные полосы знак равнотахизоит условия медиа; серые полосызнак равно 48-ч стресс-индукции.

428 GENE РЕГУЛИРОВАНИЕ
брадизоитный промоторные конструкты: SAG4.2 (P18), LDH2, BAG1, 65-кДа белок стенки цисты (CW), и Brady-NTPase. Следует отметить, что конструкция BSR4 была конститутивно экспрессируется в этих анализах, consis-палатка с частотами шалфея и EST, полученных для этого гена, а также в соответствии с конститутивной переназначения этого гена (Лаура Knoll, личное сообщение). Ряд других промоторов тестировался был низким до высокого уровня экспрессии в тахизоитах, в том числе GRA1 (показанные здесь), а также конструкций, содержащих 5'-flanking регионы для SAG1, LDH1, ENO2, DHFR, α-tubulin, ROP4, и фруктоза-1,6-бисфосфат альдолазы (не показан). последовательно выражается конструкция GRA1 промотора на более высоких уровнях, чем все остальные PROMOT-ERS, и в 100 раз выше, чем самая низкая выражается DHFR построить в тахизоит временных тестах (Behnke и белый, неопубликованные). Таким образом, тахизоит и брадизоитный промоторные области экзамена-INed с использованием двойной модели люциферазы есть, до сих пор, отображается характерный паттерн экспрессии accumu-веден, связанного с нативным белком Toxoplasma и / или мРНК (специфичности развития многих из этих маркеров рассматривается в Лионе и др., 2002).