ВВЕДЕНИЕ

Устойчивость к T.gondii, является сложной, с аспектами врожденных и адаптивными иммунными реакциями, играющих важной ролью эффекторной (Remington и Merigan, 1968; Anderson и Remington, 1974; Hoff и Френкель, 1974; Френкель и Caldwell, 1975;. Anderson и др 1976; Линдберг и Я.И., 1977; Маклеод и Ремингтон, 1977a; Маклеод и др, 1985a, 1985b, 1989a, 1989b;. Мюррей и др, 1985a, 1985b;. Хан и др 1988a, 1988b, 1996a, 1996b;. Danneman и др., 1989,. Ян и др, 1989; Адамс и др, 1990;. Браун и МакЛеод, 1990; Арауйо, 1991, 1992;. Паркер и др
1991; Gazzinelli и др, 1992a. Шер и Кофман, 1992; Chardes и Бут, 1993; Denkers и др, 1993a, 1993b, 1993c, 1997a, 1997b, 2003a, 2003b. Сааведра и Herion, 1993; Aosai и др., 1994; Бал и др., 1994; Chardes и др., 1994; Deckert-Шлютер и др 1994a, 1994b, 1996, 1998а, 1998b. Хантер и др, 1994а, 1994b, 1995a, 1995b, 1995c. Shirahata и др., 1994; Браун и др, 1995a. Amichay и др., 1996; Монтойя и др., 1996; Purner и др., 1996; Сааведра и др., 1996; Liesenfeld и др., 1997; Доббин и др., 2002; Либерман и Хантер, 2002; Liesenfeld, 2002; Кан и др., 2003; Ман и др, 2003а, 2003b. Abou-Bacar и др, 2004а. Kasper и соавт., 2004; Mennechet
Токсоплазма. Модельные Apicomplexan-перспективы и методы, под редакцией Weiss & Kim
ISBN-13: 978-0-12-369542-0
ISBN-10: 0-12-369542-2
Copyright © 2007 Elsevier Ltd.
Все права воспроизведения в любой форме зарезервированы.

610 Иммунитет и АДАПТИВНАЯ генетика иммунного ответа хозяина
и другие., 2004; Rachinel и др., 2004) (табл 23.1, 23.2). Врожденная иммунная система также имеет важную значение в вождении и диктует качество адаптивного иммунного ответа (Яно и др., 1989, Шер и др, 1991, 1992, 1993;. Curiel и соавт, 1993;. Bendelac, 1995; Bendelac и др аль, 1995;.. Denkers и др, 1996, 1997а, 1997b;. Gazinelli и др, 1996a; Кос и Engleman, 1996; Scharton-Керстен и др, 1996a, 1997a, 1997b;.. Del Rio и др, 2001, 2004; Caamaño и Hunter, 2002; Сакс и Sher, 2002;. Maeckner и др, 2005;. Chan и др, 2006).
Способность Т. гондий заразить любую клетку означает, что заболевание может быть системным и влияет на многие органы, но в некоторых случаях некоторые органы, ВКЛЮЧАЕТ ингу мозга, глаза, или кишечник, имеет predomi-Нан патологию. Эти отдельные органы были подробно изучены с использованием животных, чаще всего мышиного, моделей заболевания. Сильное влияние принимающих генетики на этом процессе болезни было очевидно из ранних исследований, и было использовано для иден-тифов иммунологических функциональных коррелятов ProTec-ции и патологий (Johnson, 1984;. McLeod и др 1989a, 1989b, 1995, 1996, Браун и МакЛеод, 1990; Blackwell и др, 1993, 1994;. Браун и др 1995b;. Монтойя и Remington, 1997, Blackwell, 1998, Mack и др, 1999;. Mordue и др., 2001; Ottenhoff и др аль, 2002;. Вилчес и Пархи, 2002; Trowsdale и Пархи, 2004;. Морел и др, 2005). Отбор генетически различных штаммов мышей с особой восприимчивостью к различным проявлениям заболевания позволил тщательно рассечение иммунных реакций в различных органах, а также предоставляет ценную информацию о проявлениях болезни у людей с различными формами заболевания. В частности, они включают в себя токсоплазматический энцефалит (TE) (Ghatak и Zimmerman, 1973;. Hoff и др, 1976; Jones и др, 1977;.. Мазур и др, 1978; Фергюсон и Hutchison, 1987a, 1987b; Holland и др., 1988; Israelski и др., 1989, Сузуки и др, 1989, 1991а;. Фулон и др, 1990;. Сузуки и Ремингтон, 1990, 1993;.. Gazzinelli и др, 1992a, 1992b, 1992c, 1993a; Kwon и др аль, 1992;.. Сузуки и др, 1993a, 1993b;. Deckert-Шлютер и др, 1994c, 1995, 1996, 1998а, 1998b, 1999; Сузуки и Джох, 1994; Браун и др 1995b;. Minamidani и др., 1996; Suzuki, 1997; Шлютер и др., 1998; Luder и др., 1999, 2003а,
2003b; Кан и Сузуки, 2001; Кан и др., 2003;.. Квки и др 2003), а также глазной токсоплазмоз (ОТ) (Gazzinelli и др 1994а; Робертс и Маклеод, 1999;. Роберт и др, 2000).
Влияние Т. Gondii генетики на пато-генезе как мышиного и человеческого Т. Gondii Infec Тион становится все более очевидным в последние годы. В экспериментальных исследованиях, маршрут и этап жизненного цикла используется для инициирования инфекции варьировались в зависимости от удобства или научного обоснования, или вызывать определенные заболевания manifes-tations, а также следует отметить при рассмотрении исследований в литературе. Важно также, чтобы попытаться соотнести выводы моделей животных с клиническими данными и исследованиями человеческих материалов (Френкель, 1955, 1990; Hogan и др, 1958;. Эйхенвальд, 1960; Hogan, 1961; Desmonts, 1966; Vainisi и Кэмпбелл, 1969; Desmonts и Куврёр, 1974, 1984; Коппе и др, 1974, 1986;. Hoerni и др, 1978;. Мюррей и др, 1979, 1980, 1985а, 1985b;. Ryning и др, 1979;. Уилсон и Remington, 1979;. Маклеод и др, 1980, 1984, 1985а, 1985b, 1988, 1990, 2006; Вильсон и др 1980a, 1980b. Люфт и др, 1983, 1984а, 1984b.. Куврёр и др, 1984, 1991, 1993; Натан и др., 1984; Уилсон и Хаас, 1984; Wilson, 1985; Catterall и др., 1986; Dutton и др., 1986; Маклеод и Mack, 1986; Daffos и др., 1988; Силвейра и др., 1988; Даттон, 1989; Hohlfeld и др., 1989; Ян и др., 1989; Браун и Маклеод, 1990; Huskinson и др., 1990; Mitchell и др., 1990; Sibalic и др., 1990; Бюлов и Boothroyd, 1991; Хантер и др., 1992; Робертс и Александр, 1992; Бергер и др., 1993; Curiel и соавт., 1993; Вонг и др., 1993; Брезины и др., 1994; Макаули и др., 1994; Биггс и др., 1995; Ченнон и Kasper, 1996; Декостер, 1996; Purner и др., 1996; Vogel и др., 1996; Бузони-Gatel и др., 1997; Метс и др., 1997; Бернетт и др., 1998;. Subauste и др, 1998а, 1998b; Гормли и др., 1999; Мак и др., 1999; Ченнон и др., 2000; Ли и др., 2000; Маклеод и Доуэля, 2000; Blader и др., 2001; Labalette и др., 2001; Силвейра и др., 2001; Caamaño и Hunter, 2002; Fardeau и др., 2002; Rothova, 2003; Holland, 2004; Валлон и др., 2004;. Cavailles и др, 2006а, 2006b; Garweg и др., 2005; Vallochi и др., 2005).
За последние десять лет произошел ряд научных, всеобъемлющие обзоры, которые описывают

| ВСТУПЛЕНИЕ |
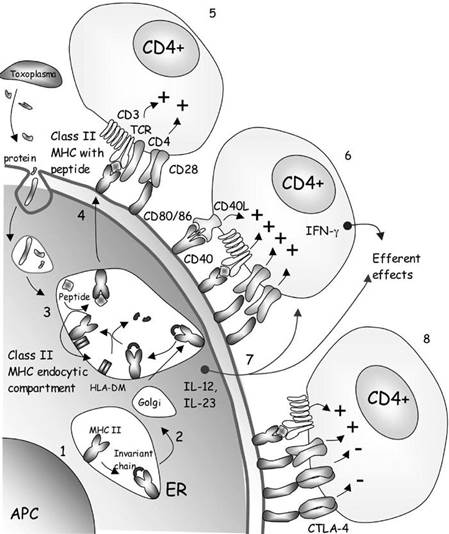
РИСУНОК 23,1 Обработка экзогенного антигена T. гондий, презентация МНС класса II и активации CD4+ Т-лимфоциты.
1. В эндоплазматической сети (ER), II МНС (МНС II) молекулы класса связаны инвариантной цепи.
2. Экспорт класса II МНС-инвариантной цепи комплекса из ER, через Гольджи и к классу II МНС эндоцитических отсеков.
3. Эндосомы, содержащие Т. гондий-белки, полученные сплавить с MHC эндоцитических отсеков класса II. Инвариантна цепь протеолитический расщеплена, позволяя интернализованную пептиды для связывания класса II MHC моль Cules. В организме человека, человеческий лейкоцитарный антиген (HLA) молекулы DM облегчают загрузку пептида.
4. молекулы МНС класса II, несущие груз пептида экспортируются в поверхность презентирующей клетки антигена (APC).
5. Пептиды представлены на классе II МНС к CD4+ Т-лимфоциты, которые взаимодействуют с помощью их поверхности α/β-TCR и CD4 молекулы. Комплекс CD3 ассоциируется сα/β-TCRs и выступать в качестве док-сайта для тирозинкиназ, которые передают сигналы активирующих внутриклеточные. CD28 на поверхности Т-клетки взаимодействует с CD80 и / или CD86 на APC, чтобы обеспечить совместную стимуляцию Т-клетки.
продолжение
6. CD40, конститутивно экспрессируется на дендритных клетках и взаимодействует с CD40-лиганд (CD40L) экспрессируется на поверхности активированных Т-клеток. Это увеличивает экспрессию CD80-86 на дендритные клетки, и усиливает Т-клетки со-стимуляцию.
7. Участие CD40 активирует дендритные клетки. Продукция цитокинов, таких как IL-12 с помощью дендритных клеток способствует дифференцировке CD4+ Т-клетки в клетки Th1, которые характеризуются IFN-γ производства, но имеют низкий или незаметный продукцию IL-4.
8. Т-клетки экспрессируют CTLA-4 на более поздних стадиях активации. Участие этого с CD80 / 86 индуцирует Nega-TIVE сигналы на Т-клетки, которые прекратить их активацию.
(Включает в себя понятия из фиг.5 в McLeod и др. (1996), а на рис 4.1 в Льюиса и Wilson (2005), с разрешения.)
Эта цифра воспроизводится в цвете в разделе Цвет пластины.

РИСУНОК 23,2 Для легенды см следующей страницы.

| ВСТУПЛЕНИЕ | ||
| клеточный иммунитет, новорожденный иммунитет, | для полноты картины. Эта глава не повторить | |
| дендритные клетки, а также обработка антигена и нали- | подробные резюме литературы уже | |
| ентация, и как каждый из этих областей имеет отношение к | представленные в этих выдающихся обзорах, но | |
| токсоплазмоз (Wilson, 1985; Wilson и др., 1986; | вместо этого включает в себя соответствующие ссылки, резюме | |
| Паркер и др., 1991; Ohtake и др., 1992; Gazinelli | рисунки и таблицы из этих ранних работ, как | |
| и другие., 1993a, 1993b, 1993c; Олле и др., 1994; | а также таблицы, созданные для этой главы | |
| Маклеод и соавт, 1995, 1996. Павлин и др., 1995; | дается обзор и наметить механизмы | |
| . Gazzinelli и др, 1996a, 2004; Хантер и др., 1996; | вовлечены в иммунный ответ Т. гондий | |
| Пелла и Амбруаз-Томас, 1996; Брунинг и др., | (На рисунках 23.1-23.6; таблицы 23.1, 23.2). Эти | |
| 1997; Denkers и др, 1997а, 1997b, 2003a, 2003b. | таблицы разработки концепции, иммуно | |
| Монтойя и Remington, 1997; Denkers и | ответ способствует как защита и | |
| Gazzinelli, 1998; Яп и Sher, 1999; Маклеод и | Патогенез заболевания, например, поражение сетчатки в | |
| Dowell, 2000; Ropert и Gazzinelli, 2000; мясник | как иммунокомпетентных и иммуно- | |
| и другие., 2001; Luder и Seeber, 2001; Butcher и | скомпрометировано человек (рис 23.7). У нас есть | |
| Denkers, 2002; Скотт и Хантер, 2002; Тейшейра | сосредоточена в этой главе о работе с нашей собственной лаборатории компании | |
| и другие., 2002; Aliberti и др, 2003, 2004. Синай и др., | ratory групп, статей, опубликованных в последнее время, что | |
| 2004; Тэйлор и др., 2004; Denkers и Мясник, | имеют такую форму и расширенные концепции в | |
| 2005; Льюис и Уилсон, 2005; Courret и др., 2006). | более ранние обзоры и документы, которые предоставили | |
| Ссылки, включенные в эти обзоры являются incorpo- | важные механистические идеи в иммунному | |
| рейтинг в списке литературы в конце этой главы, | ответ на Т. гондий. |

РИСУНОК 23,2 Обработка эндогенного презентации антигена на МНС класса I и активации CD8+
Т-лимфоциты, чтобы убить Т. гондий-инфицированные клетки:
1. Белки, выходящие или выпущенные из паразитофорной вакуоли Т. гондия протеолитически расщеплены в протеосомах и введите ER с помощью TAP (транслокатора, связанного с обработкой антигена) молекулами. Эти пептиды загружаются на молекулы в ER класса I MHC (МНС I).
2. Класс I пептидный комплекс ГКГ экспортируется из ER, через Гольджи и в конечном счете к поверхности клетки.
3. Пептиды, представленные на МНС класса I распознаются CD8+ Т-лимфоциты с помощью их поверхности α/β-TCR и CD8 молекул. Комплекс CD3, связанный сα/β-TCRs выступает в качестве док-сайта для тирозинкиназ, которые обеспечивают активируя внутриклеточные сигналы. CD28 на поверхности Т-клеток взаимодействует с CD80 и / или CD86, чтобы обеспечить совместное возбуждение для Т-клеток. CD40 экспрессируется конститутивно на дендритных клетках и на лигирования с CD40 лиганда (CD40L), экспрессируется на поверхности активированных клеток, повышает экспрессию CD80-86 на дендритных клетках, и усиливает Т-клеток со-стимуляции. Участие CD40 активирует дендритных клеток продуцировать цитокины, такие как IL-12 - рис 23,1). Дендритные клетки используют процесс, называемый «кросс-презентацией» для передачи белков, принятых как часть некротического или апоптотического мусора в класс я эндогенный маршрут обработки.
4. Цитолитические CD8+Т-клетки распознают специфические T.gondii, полученные пептиды, представленные молекулы МНС I класса. Лигирование FasL на поверхности CD8+ Т-клетка с Fas на поверхности клеток-мишеней индуцирует апоптоз клеток-мишеней.
5. После распознавания конкретных Т. гондий-производных пептидов, представленных молекулами класса I MHC, CD8+ Т-клетки могут также убить клетки-мишени путем выпуска перфорина и гранзима.
6. CD8+ Т-клетки также выделяют ИФНγ, Которые могут вызвать IDO и Inos в клетках-мишенях, которые эффективны при уничтожении Т. гондия тахизоитов.
7. На более поздних стадиях активации Т-клетки экспрессируют CTLA-4, которые, когда зацепление с CD80 / 86, подают отрицательные сигналы в Т-клетку, которые способствуют прекращению активации (см Рисунок 23.1).
(Включает в себя понятия из рис 4.1 в McLeod и др. (1996) и Рисунок 4.1 в Льюисе и Wilson (2005), с разрешением).
Эта цифра воспроизводится в цвете в разделе Цвет пластины.

614 Иммунитет и АДАПТИВНАЯ генетика иммунного ответа хозяина

РИСУНОК 23,3 Предлагаемые афферентные взаимодействия дендритных клеток с токсоплазмозом, NK, CD8+Т, и CD4+Т-клетки.
1. Т. гондий выпускает ряд молекул, которые имеют иммунологические эффекты. GIPL связывает TLR-4, профилин связывает TLR-11, и Ср-18 связывает CCR5 и HSP70, который индуцирует созревание дендритных клеток через неизвестный механизм (не все из этих взаимодействий могут произойти у всех млекопитающих, и TLR-11, по-видимому не является функциональной в людях).
2. Чистый эффект этих молекул активации дендритных клеток и созревание с вероятным производством IFN, IL-12, IL-15, IL-18, IL-23, и ИЛ-27. Эти медиаторы действуют на клетки NK и CD4+ и CD8+ Т-клетки.
3. NK-клетки продуцируют IFN-γ которые вместе с IL-12, способствует Th1-клетки, в отличие от Th2-клеток созревания.
4. CD4+ Производство Т-клеток ИЛ-2 дополнительно активирует клетки NK и способствует расширению цитолитического CD8+ Т-клетки, которые могут убить Т. гондий-инфицированные клетки, с помощью ряда методов (см Рисунок 23.2).
(Включает в себя понятия из фиг.5 в McLeod и др. (1996) и на рисунке 4.2 в Льюиса и Wilson (2005), с разрешения.)

| MOUSE ГЕНЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ |

РИСУНОК 23,4 Предлагаемые нормативные взаимодействия дендритных и мононуклеарных фагоцитов с токсоплазмозом, NK, CD8+Т, и CD4+Т-клетка (Th1 и Th2), NKT, и регуляторные Т-клетки. Обратите внимание, дифференцировку CD4 клеток в Th1 и Th2 клетки, а также взаимодействие с NKT клетками и регуляторными Т-клетками. NKT-клетки распознают гликолипиды в присутствии CD1. (Включает в себя понятия из фиг.5 в McLeod и др. (1996) и Рисунок 4.2 в Льюиса и Wilson (2005), с разрешения.) Эта цифра воспроизводится в цвете в разделе Цвет пластины.
MOUSE ГЕНЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ

Смертность
Роль для Н-2 комплекса (МНС) в опосредовании защиты или присвоении восприимчивости к мышам, измеряли как выживаемость после внутрибрюшинного заражения Т. гондий, была впервые продемонстрирована Williams и коллегами (Williams и др., 1978). В этом исследовании, восприимчивость установлено, что связано с Н-2а и Н-2b гаплотипов, тогда как сопротивление было связано с Н-2d и Н-2k гаплотипов. Восприимчивость как измерено смертном-Ity является сложной чертой, и исследователи, даже в этом раннем исследовании, признали, что другие гены были вовлечены. Джонс и его коллеги признали, что штамм мыши под влиянием число кисты мозга (Джонс и др., 1977).
Для того, чтобы разработать модель более биологически как естественно приобретенной инфекцию, естественная история и патологию инфекции в различных штаммах мышей и токсоплазмы были охарактеризованы, и образцы восприимчивости на основе генотипа хозяина и различных паразиты изолят были отмечены (Маклеод и др., 1984). Штамм ME49 был выбран для дальнейших исследований, так как это вызвало небольшую смертность и высокую нагрузку кисты, а при введении на одиннадцатый день беременности привел к 100-процентной передаче плода в беспородном мышее Swiss-Webster. Таким образом, эта модель может быть использована для проверки влияния ослабленных вакцин - т.е. чувствительной к температуре мутанта 4 (TS-4) вакцинный штамм - на врожденной передаче Т. гондия (McLeod и др., 1984).

616 Иммунитет и АДАПТИВНАЯ генетика иммунного ответа хозяина

РИСУНОК 23.5 Дифференциация по антигенным наивным CD4+Т-клетки в Th1, Th2, неполяризованный, и фолликулярных хелпер-эффекторные и Т-клеток памяти. Антигенно наивные CD4+клетки экспрессируют высокие уровни CD45RA изоформы CD45 поверхности протеинтирозинфосфатазы. Они активирует антиген, представленный антиген-представляющие клетки (АРС), чтобы выразить CD40 лиганд и интерлейкин (IL) -2, и пройти клональную экспансию и дифференцировки, что сопровождается экспрессией изоформы CD45RO и потерями CD45RA изоформы. Большинство эффекторных клеток погибают вследствие апоптоза, но небольшая часть этих клеток в качестве клеток сохраняются памяти, которые экспрессируют высокие уровни CD45RO. Воздействие расширения эффекторных клеток к IL-12 семейства цитокинов, IL-18 и интерферона (ИФН) -γ способствует их дифференцировке в эффекторные клетки Th1, которые секретируют IFN-γ, В то время как экспо-Sure к IL-4 способствует их дифференцировке в эффекторные клетки Th1, которые секретируют IL-4, IL-5 и IL-13. Многие ячейки памяти не являются поляризованными и не выражают либо Th1 или Th2 цитокины. Они могут быть обогащен для клеток, которые продолжают экспрессируют рецептор CCR7 хемокинов, которая способствует их рециркуляции между Th2 цитокинов. Они также могут быть обогащены для клеток, которые продолжают экспрессируют рецептор CCR7 хемокинов, которая способствует их рециркуляции между кровью и лимфатических узлов и селезенки. Т-клетки-помощники фолликулярная, которые экспрессируют высокие уровни CXCR5, перемещаться в районы фолликул В-клеток, в которых они выражают CD4O лиганд и обеспечивают помощь для реакций B-клеток. Сигналы, которые способствуют накоплению фолликулярных клеток-хелперов Т-памяти и их способности продуцировать цитокин мало изучены. Ячейки памяти повторно заражали с анти-геном подвергаются быстрой клональной экспансии на вторичные эффекторные клетки, которые опосредуют одни и ту же функцию, что и исходная популяция памяти. Большинство вторичных эффекторных клеток в конце концов умирают от апоптоза. (Адаптировано из рисунка 4.6 в Льюисе и Wilson (2005), с разрешением.)
Эта цифра воспроизводится в цвете в разделе Цвет пластины.
| Образование с помощью инбредных, а затем, рекомбинантного | регулируется как минимум пяти генов, один из |
| конгенный, ген-дефицитный и трансгенные штаммы | который отображает на область Н-2 (рис 23.8, 23.9) |
| мышей (Маклеод и др 1989а;. 1989b; Браун и | (Маклеод и др., 1989b). Важное наблюдение |
| Маклеода, 1990; Браун и др 1995b. Джонсон и др., | в этой работе является то, что это не простая ассоциация |
| 2002a, 2002b; Смайли и др., 2005). Способность мышей | между развитием мозга киста бремени, |
| чтобы выжить в течение первых 30 дней после инфекции, когда | и смертность (Маклеода и др., 1984, 1989а, 1989b). |
| штамм ME49 Т. гондий вводили перорально | Путь заражения был обнаружен влияние |
| Было установлено, что под полигенному контролем и быть | Смертность в экспериментальном токсоплазмозе (Johnson, |

| MOUSE ГЕНЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ | ||
| 1984; Маклеода и др., 1989а). Например, C57BL / 6 | оральный путь. Характеристики воспалительные | |
| были обнаружены у мышей, чтобы быть восприимчивы к оральному infec- | реагирования и паразитарные антигены (например, SAG1) | |
| Тион, но устойчив к внутрибрюшинному инфекции | участвует в этом воспалительном заболевании кишечника | |
| (Джонсон, 1984;. Маклеод и др 1989а). По сравнению, | следующий пероральные инфекции были определены | |
| LACA мышей показали обратные характеристики | (Liesenfeld и соавт, 1996, 1999;. Александр и др., 1997; | |
| (Джонсон, 1984). Интересно, что дендритные клетки | Александр и Хантер, 1998; Александр и др., 1998; | |
| распространение Т. Gondii на ранней стадии из кишечника | Сузуки и др., 2000a; Nickdel и др., 2004). гены | |
| мозг (Courret и др., 2006). В качестве отдельного | участвует в восприимчивости C57BL / 6 мышей в | |
| аспект патогенеза, связанный с пероральным | оральная инфекция, была изучена с генетическим картированием | |
| приобретение, исследования показали, что C57BL / 6 | выживания А × В и В × Мыши следующие | |
| мыши развивают фатальный энтерит, когда инфицированная | пероральные инфекции. Последующие анализы | этот |

Фигура 23.6 (А) Предполагаемые этапы человеческойαβ-T-клеточный рецептор-позитивных (αβ-TCR+) Развитие тимоцитов. Prothymocytes, экспрессирующие CD7 производятся в костном мозге или печени плода. Они входят в тимус с помощью сосудов на стыке между тимуса коркового и мозгового вещества. В тимусе, эти клетки дифференцируются в более зрелыеβ-TCR+ тимоцитов (определяется их узором из αβ-TCR-CD3-комплекс, CD4, CD8, CD38 и). Перестройка TCRα и TCR βГены цепи происходит в наружной коре. Положительный отбор происходит в основном в центральной коре тимуса и включает в себя взаимодействие тимуса эпителиальных клеток. Отрицательный отбор происходит в основном в мозговом, и включает в себя взаимодействие тимуса дендритных клеток. Сердцевинные тимоцитов эмигрировать в обращение и колонизировать периферические лимфоидные органы. Эти Т-клетки CD4 являются+ и CD8+ с высокими уровнями из αβ-TCR-CD3 комплекс. Эти клетки называются «последние тимуса эмигрантов» (ПСП), и, вероятно, лишены экспрессии CD38 поверхности. (Модифицированная из рис 4.3 в Льюисе и Wilson (2005), с разрешением.)
(B) Передача и тяжести заболевания в каждом триместре беременности. В общем, как беременность прогрессирует частоту материнского плода возрастают передачи и тяжесть заболевания у новорожденного уменьшается. Эта цифра воспроизводится в цвете в разделе Цвет пластины.

| Иммунитет и АДАПТИВНАЯ генетика иммунного ответа хозяина | ||||||||
| С | беременность | рождения | 6 месяцев | 1 год | ||||
| NK клетки | 6 недель, присутствующие в печени | 15% от общего количества лимфоцитов | Полный цитолитическая | |||||
| Двойной абсолютный | деятельность достигла | |||||||
| номер присутствует у взрослых | в конце младенчества | |||||||
| 50% взрослых цитолитический | ||||||||
| деятельность | ||||||||
| Общее увеличение числа | ||||||||
| но снижение функции | ||||||||
| моноциты / | 4 недели, обнаруженная в желтке | количество моноцитов | Хемотаксиса <взрослый | |||||
| макрофаг | мешок затем печень и костный | > взрослые | 6-10 лет | |||||
| & | костный мозг | IL-1 составляет для взрослых | ||||||
| Сниженная IL-6 и | ||||||||
| дендритные клетки | ||||||||
| ФНО-α | ||||||||
| Пуповинная кровь DC меньше | ||||||||
| эффективный, чем взрослый | ||||||||
| Поддержка Т-клеток | ||||||||
| Нейтрофильная | Ограниченный пул хранения. | 50-60% циркулирующих | ||||||
| 14-16 недель, прекурсоры | лейкоциты | |||||||
| видели | 40-45% клея | |||||||
| 22-24 недель, 10% | способность к эндотелию | |||||||
| циркулирующих лейкоцитов | Плохо хемотаксическая способность | |||||||
| Нормальный супероксид | ||||||||
| анион | ||||||||
| Снижение гидроксил | ||||||||
| радикалы | ||||||||
| эозинофил | 18-30 недель, | Послеродовой пик на 3-4 | ||||||
| 10-20% от общего granulo- | недель | |||||||
| cytes | ||||||||
| Т-клетки | 7 недель, обнаруженные в желтке | Виргинские подмножество Т-клетки | Пик Т-клеток номер | Для взрослых Т-клеток | ||||
| мешок и печень | Нормальный синтез IL-2 | количество, возраст 4 | ||||||
| 8 недель, лимфоидной colo- | и экспрессии IL-2R | Пик размера | ||||||
| низация и снижение | Снижение ФНО-α, ИЛ-3, | тимус, возраст 10 | ||||||
| TCR разнообразие и TdT | IL-4, IL-5, IFN-γ и | |||||||
| активность фермента | GM-CSF | |||||||
| 10 недель, лимфоидных | Переменная активность CTL | |||||||
| ткани, печень и костный | Diminshed производство | |||||||
| костный мозг | ИФН-гамма | Снижение кожи | ||||||
| 14 недель, все три | Реакция сохраняется до | |||||||
| тимоцитов в надлежащее | ||||||||
| возраст 1 | ||||||||
| место нахождения | ||||||||
| 16 недель, улучшение TCR | Нет DTH реакции кожи | |||||||
| разнообразие и TdT деятельность | антигены и уменьшенный | |||||||
| реакция после стимуляции | ||||||||
| В-клетка | 8 недель, материнский IgG | Т1-1 тип антиген | Т1-2 типа антигена | Циркуляционный IgG является | ||||
| пересекает плаценту | ответ | Ответ на encap- | почти все из | |||||
| (Большинство в утробе матери) | Т-зависимый ответ | организмы изолированных друг | Младенец (надир в | |||||
| 15 недель, IgM-секретирующих | первичный | Максимальный IgM в | 3-4 месяца) | |||||
| плазматические клетки присутствуют | 2-6months | |||||||
| 17 недель, некоторые цир- | ||||||||
| тины плод IgG, может быть сначала | ||||||||
| видели | ||||||||
| 20-30 недель, IGG и Iga | ||||||||
| плазматические клетки появляются первыми | ||||||||
| Тип CD | NK CD16 на 6 недель ges- | NK-CD56 50% | ||||||
| ставляют | NK CD57 снизилась | |||||||
| Т-клеточные тимоцитов выразить | ||||||||
| CD7 на 7-й неделе беременности | ||||||||
| Т-клеточные тимоцитов выразить | Большинство Cd4† Т-клетки экспрессируют | |||||||
| CD3, CD7, CD4, CD8 и | CD45RA+ клетки → | |||||||
| CD45RA | + | Маркер (наивный) | ||||||
| на 12-14-й неделе беременности | CD45RO+ с | |||||||
| Т-клеточные тимоцитов выразить | возраст и антиген | |||||||
| CD4 или CD8> 14 недель | ||||||||
| стимуляция | ||||||||
| беременность | ||||||||