| L | ||||||||||||||||
| (%) | ||||||||||||||||
| смертность | Женский Опыт 1 | (N = 50) | ||||||||||||||
| кумулятивный | Мужчина exp1 (N = 50) | |||||||||||||||
| Женский Опыт 2 | (N = 50) | |||||||||||||||
| Мужской Опыт 2 (N = 48) | ||||||||||||||||
Через несколько дней после заражения
Рисунок 23.10 продолжение (В), (С) Отсутствие защитного эффекта Ldген на выживание с различными дозами или маршрутов Toxoplama гондий. (Б) лd не приводит к увеличению или значительно снизить выживаемость с высоким или низким INOC-ул (P >0,05). (С) лd не приводит к увеличению или значительно снизить выживаемость в пероральной или парентеральной инфекции (Р >0,05). Возраст в месяцах указывается после деформации мыши. ро, пероральный; ф, внутрибрюшинно.
(D) - (G) Влияние мутации дм2 на выживание молодых и старых мышей BALB / с. Мутация Dm2 Dimin-выживание в нуль молодых и старых мышей после пероральной инфекции (D, F), а также молодых мышей после парентерального заражения (E, G). Старый мышей как дикий тип BALB / с и с мутацией дм2 более восприимчив, чем у молодого мышей (P<0,05). (F) Возраст в месяцах указываются после штамма мыши.
(H) - (K) Влияние маршрута и возраста на выживание C3H.Ldмышей. Увеличение возраста (месячный возраст показал после штамма мышь) лишь незначительно повышает восприимчивость к пероральной инфекции (P>0,05) (Н, J), но заметно повышает восприимчивость к родительской инфекции (Р<0,05) (I, K). Ld не существенно увеличивать или уменьшать выживание.
(L) Влияние пола на выживаемость мышей дм2. Самок мышей штамма дм2 заметно больше suscep-TIBLE, чем у мужчин (P<0,001).
(Адаптировано из Johnson и др. (2002b), с разрешением.)

| MOUSE ГЕНЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ |
1993b, 1994a, 1994b, 1994c, 1996a, 1996b, 2000a, 2000b; Сузуки и Ремингтон, 1990;. Gazzinelli и др, 1992a, 1993b; Deckert-Шлютер и др, 1994а, 1996, 1998а, 1998b., 1999; Браун и др 1995b. Luder и др., 1999, 2003а, 2003b). Они выявили важность хозяина и паразита генетики. гены МНС, как представляется, играют доминирующую роль, но ген NRAMP (ранее ITY / БЦЖ / LSH) и локусы на хромосомах 1, 4, 17 и 18 также были вовлечены в играть дополнительную роль (McLeod и др., 1989b; Blackwell, и др, 1994;.. Джонсон и др, 2002) (рис 23.9, 23.11; Таблица 23.3). Тщательное отображение инбредного, конгенный, ген-дефицитный (нокаут) и трансгенные линии мышея показали окончательно, что ген Л.Д., класс мышей я ген МНС, играет важную роль в защите некоторых штаммов мышей против токсоплазматического энцефалита, вызванного штаммами T.gondii, тип II (Джонсон и др, 2002b). (Фигуры 23.10H-Л, 23.12-23.14; Таблица 23.4). 1 ген NRAMP Ит / БЦЖ / Lsh проявляет аналогичное (хотя незначительный) воздействие на производстве ткани цист (рисунок 23.11). Мыши Defi-Cient в иммунологический важных генах (таблица 23.2) также предоставил много полезной информацию, а в некоторых случаях подтвердил защитную или exacerba-Тори роли для многих других иммунологических коих-нентов в токсоплазматическом энцефалите. В других случаях отсутствие определенного гена произвело в неожиданных результатах, и полиморфизмы в этих генах или их промоторах, вероятно, объяснить наблюдаемые различия между мышиными моделями. Таблица 23.4). 1 ген NRAMP Ит / БЦЖ / Lsh проявляет аналогичное (хотя незначительный) воздействие на производстве ткани цист (рисунок 23.11). Мыши Defi-Cient в иммунологический важных генах (таблица 23.2) также предоставил много полезной информацию, а в некоторых случаях подтвердил защитную или exacerba-Тори роли для многих других иммунологических коих-нентов в токсоплазматическом энцефалите. В других случаях отсутствие определенного гена произвело в неожиданных результатах, и полиморфизмы в этих генах или их промоторах, вероятно, объяснить наблюдаемые различия между мышиными моделями. Таблица 23.4). 1 ген NRAMP Ит / БЦЖ / Lsh проявляет аналогичное (хотя незначительный) воздействие на производстве ткани цист (рисунок 23.11). Мыши Defi-Cient в иммунологический важных генах (таблица 23.2) также предоставил много полезной информацию, а в некоторых случаях подтвердил защитную или exacerba-Тори роли для многих других иммунологических коих-нентов в токсоплазматическом энцефалите. В других случаях отсутствие определенного гена произвело в неожиданных результатах, и полиморфизмы в этих генах или их промоторах, вероятно, объяснить наблюдаемые различия между мышиными моделями. а в некоторых случаях подтвердили защитную или exacerba-тори роли для многих других иммунологических коих-нентов в токсоплазматическом энцефалите. В других случаях отсутствие определенного гена произвело в неожиданных результатах, и полиморфизмы в этих генах или их промоторах, вероятно, объяснить наблюдаемые различия между мышиными моделями. а в некоторых случаях подтвердили защитную или exacerba-тори роли для многих других иммунологических коих-нентов в токсоплазматическом энцефалите. В других случаях отсутствие определенного гена произвело в неожиданных результатах, и полиморфизмы в этих генах или их промоторах, вероятно, объяснить наблюдаемые различия между мышиными моделями.
Т. гондий воздействие на мозг и иммунный ответ рассматриваются в глубину в главе 21. Было показано, что врожденные и взрослых приобретение заражению мышей приводит к различным моделей, так же, как картины болезней у людей (Deckert-Шлютер и др., 1994а), В частности, у мышой NMRI следующие пренатальная инфекции с низкой дозой штаммом ДК Т. гондием, новорожденные мыши были очаги некроза, внутримозговой кальцификации и Ventri-culitis, напоминающая человеческий врожденный toxoplasmo-Сис. Воспалительные реакции включали макрофаги, гранулоциты и астроциты (Deckert-SCHLÜTER и др., 1994а). При хроническом токсоплазматическом энцефалите, набор Т-клетках прекращает и апоптоз CD4+ и CD8+Т-клетки происходили; тем не менее, внутримозговые Т-клетки, которые уже были набраны
| 103 | ||||
| 102 | ||||
| число | 101 | |||
| Киста | ||||
| 100 | ||||
| 10-1 | ||||






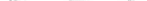
B10.A. Bcg B10.ASgSn / Дж C57BL / 10SnJ
штамм мыши
РИСУНОК 23,11 Исследования с конгенными мышами демона-зали большое влияние сложного и незначительного влияния Н-2 локуса Bcg (Nramp) о количестве кист головного мозга следующего пероральном инфекции. Количество цист (за 10μл) в головном мозге мышей В10 конгенных через 30 дней после перорального заражения токсоплазма. Круги представляют мышей с Н-2 гаплотипом. Твердые символы представляют мышей, которые БЦЖ устойчивы, и открытые символы представляют мышей, которые БЦЖ чувствительны. Данные из двух экспериментов, дублированных с аналогичными результатами. Различия между H-2a и 2b Н-мышей были высоко СИГВВП-ficant независимо от их типа BCG (Р<0,001). Чем меньше разница между B10.A.Bcg р и B10.AsgSn / J мышей также были значимыми (Р <0.01). В этих экспериментах, контроль А / J мышей имели низкие числа цист и C57BL / 6J мыши имели высокие числа цист, как и во всех других экспериментах. (Адаптировано из McLeod и др. (1989b), с разрешением.)
сохраняется (Шлютер и др, 1997;.. Deckert-Шлютер и др, 1999). Сузуки отметил, что иммунные ответы на различные штаммы T. гондий в головном мозге мышей не всегда одинакова во острой и хронической инфекции (Сузуки и др., 1993b), а также различные типы клеток, могут участвовать в ранее, а затем иммунные ответы, Suzuki также недавно идентифицированы Vβ8 CD8+Ld-ограниченный Т-клетка, которые являются Т. гондии антигена-специфическим в головном мозге chroni-ский инфицированный, генетически устойчивого мышей BALB / C. Это население Т-клеток может передавать защиту наивных мышей (Wang и др., 2005).
В исследовании хемокинов в C57BL / 6 (suscep-TIBLE к токсоплазматического энцефалита) взрослых мышей, CR G-2 / IP-10, MuMiG, RANTES, MCP-1, MIP-1α, а также

646 Иммунитет и АДАПТИВНАЯ генетика иммунного ответа хозяина
A
мышь
штамм
C57BL / 10J
B10.BAR12
B10.BAR6
B10.RKDB
А / J
C3H / HeJ
C3H.Ld
BALB / с
BALB / CH-2дм2
В
| K2 | К |
| центромера | |
| 43,18 | 44,18 |
MHC локусы
| Киста и | ||||||||||
| К | A | Е | D | L | контроль качества | энцефалит | ||||
| фенотип | ||||||||||
| б | б | б | б | б | a | восприимчивый | ||||
| б | б | б | d | d | резистентный | |||||
| К | К | К | б | б | восприимчивый | |||||
| К | К | К | d | б | б | восприимчивый | ||||
| К | К | К | d | d | a | резистентный | ||||
| К | К | К | К | К | б | восприимчивый | ||||
| К | К | К | К | К | б | резистентный | ||||
| d | ||||||||||
| d | d | d | d | d | б | резистентный | ||||
| d | d | d | d | б | восприимчивый | |||||
| хромосома мышь 17 | ||||||||||
| AaAaEb1Eb2 | Еа | C4 | С2 | αTNF | βTNF | D | D2D3D4LQ1 | |||
| см | ||||||||||
| 64.65.65. | 67. | 70. | 80. | 86. | 05. | 06. | 09. | 10.11.12.13.14. |

РИСУНОК 23,12 Исследования Mapping, которые указывают, что сопротивление нагрузки мозг паразита и энцефалит регулируются Ld ген.
(A) MHC гаплотипы мыши штаммов, используемых для определения контрольного локуса для формирования кист следующего пероральном токсоплазма инфекции.
(B) Принципиальная электрическая схема, указывающая местоположение этих локусов MHC на хромосоме мыши 17. Контроль устойчивости к кистам бремени следующему пероральной инфекции с Т. гондий была нанесена на карту ранее в области мышиной хромосомы 17 приблизительно 140 кб (McLeod и др, 1989b. Браун и Маклеод, 1990). Эта область является смежной с и содержит класс 1 ген Ld, Устойчивость к развитию токсоплазматического энцефалита также сообщалось находиться под контролем генов в этой области H-2, Сузуки и др. (1991c). ФНО-A, D и L генов, а также неидентифицированные гены, находятся в этом регионе. Исследования были проведены, чтобы иден-тифы гена (ы) в 140-кб области, который придает устойчивость к кистам и энцефалиту (Браун и др., 1995b).

| MOUSE ГЕНЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ |
MIP-1βдостиг более высоких максимальных уровней выше по сравнению с BALB / C (устойчиво к Тохо-плазменному энцефалита) мышей. В обоих мышиных моделях, астроциты и микроглии производства CRG-2 / IP10 и MCP или RANTES и MuMiG соответствен-венно, и лейкоциты расшифрованы CRG-2 / IP10, MCP-1 и RANTES. Генетические факторы оказали сильное влияние на внутримозговых хемокинов. В отдельном исследовании, хемокины были дифференцированно выражены астроцитами (Grg-2 / IP-10, MCP-1), микроглии (RANTES), и воспалительным Leuko-cytes, и были критически регулируются IFN-γ, IFN-γдефицитный мышей не производит CRG-2 / IP10, MuMiG или RANTES, и выраженные уменьшенные количества MIP-1 альфа, MIP-1 бета и МСР-1 мРНК, уменьшающиеся набора лейкоцитов через гематоэнцефалический барьер. Эти исследователи заявили, что «Т-клетки являются единственным источником IFN-γгамма в токсоплазматическом энцефалите и, таким образом, привести к паразитам в паренхиме головного мозга. Использование пероральной инфекции B6C (Н-2 {Ь× д}) мышей с Т. гондий выражая βгалактозидазы и мониторинга CD8 Т-клеток с МНС класса I. тетрамера окрашивание, Квок и др. (2003) обнаружили, что в первичной инфекции только тахизоиты индуцированной CD8+ Т-клетки, но во втором-ичных инфекции тахизоиты и bradyzoites тран-siently увеличилась внутримозговое CD8+ Т-клетки, специфические для βгалактозидазы. На 23 дней после Infec-ции, как мозг и селезенка имели высокие уровни этих конкретных CD8+Т-клетки; Однако, после этого времени число этих клеток уменьшалось в селезенке, но Т-клетки оставались на высоком уровне в головном мозге. Эти клетки продуцировали IFN-γ и были цитолитическими.
Инактивация гена VCAM в VCAM (Flox / Flox Мх Cre) мыши приводили к отсутствию индукции

VCAM-1 на эндотелиальных клетках головного мозга кровеносных сосудов (но не сосудистом сплетении эпителиальные клетки или эпендиме), и устойчивость к Т. гондий был Аболь-бедных и обнищавших слоев в сочетании с пониженной ответ В-клеток, Т. гондий-специфические Т-клетки, внутримозговые и микроглии активации; Однако, лейкоциты продолжали дома через кровеносные сосуды головного мозга (Deckert и др., 2003). LT-α и TNF-αбыли TiAl-Эссене для контроля внутримозгового токсоплазмоза, в том числе, что вызвано темпера-р-чувствительного 4 (TS-4) мутантом Т. гондия (Шлютер и др., 2003). Антиоксидантные системы в Т. гондий и цитоплазматической каталазы в защите от окислительного повреждения также были изучены (Ding и др., 2005). Использование CD45 конгенных и химерных мышей, была микроглии продукция цитокинов (TNF-α, IL-Iβ, ИЛ-10, ИЛ-15 в нормальном головном мозге; IL-12 p40, иОАС, увеличение IL-1β и TNF-α, Непрерывный ИЛ-10, ИЛ-15 и индукцию МНС класса I и II, молекул и ICAM и LFA 1). Истощение CD4+ и CD8+ Т-клетки показали, что экспрессия цитокинов регулируется CD8+Т-клетка, и экспрессия клеточной поверхности моль лекул была менее зависимыми от Т-клеток. Т-лимфоциты, регулируемые микроглии в головном мозге (Шлютер и др., 2001). В отдельном исследовании, интерлейкин 10 подавляются внутримозговой иммунный ответ при хроническом Т. гондий энцефалита, и вполне возможно, что он может способствовать паразитировать настойчивости в головном мозге (Deckert-Шлютере и др, 1995, 1999;.. Шлютер и др, 1991, 1997). В другом исследовании, IFN-γРецептор опосредованного сигнализации, но не ФНО-рецептора типа I или 2 опосредованной сигнализации, имеет решающее значение для активации мозга эндотелиальных клеток кровеносных сосудов и микроглии в мышиной Toxoplasma энцефалита. Это было продемонстрировано на мышах без ИФНγ рецепторы
В этом исследовании, относительная устойчивость к Т. гондий организмов и кист нагрузки в головном мозге, и токсоплазматического encephali-тис 30 дней после пероральной инфекции Т. гондий, коррелировали с присутствием Ld гена в инбредной, рекомбинантный, мутанта, и C3H.Ldтрансгенных мышей. Мыши, которые были устойчивы к кист и энцефалит имели мало обнаруживаемого экспрессию мРНК мозга цитокина, тогда как у мышей, которые были восприимчивы имели повышенные уровни мРНК для широкого спектра цитокинов, в соответствии с их большими количествами воспаления. Эта работа окончательно доказывает, что и Ld-ограниченный ответ уменьшает количество организмов и кист в головном мозге и тем самом ограничивает токсоплазматический энцефалит и уровней IFN-γ, TNF-α, ИЛ-2, ИЛ-6, ИЛ-10, TGF-β, IL-1α, IL-1βИ макрофаги ингибирующего мРНК белка в головном мозге через 30 дней после пероральной инфекции. Штучной X указывает на то, что гаплотип в этом локусе до сих пор не определена. Вылупившийся квадрат обозначает делецию Ldген. (Адаптировано из Браун и др. (1995b), с разрешением.)

| Иммунитет и АДАПТИВНАЯ генетика иммунного ответа хозяина | |||||||
| A | |||||||
| Штамм | Ld ген | Гематоксилин и эозин | иммунопероксидазной | ||||
| мышь | |||||||

a
BALB / с подарок

с
C3H.Ld подарок

е
C3H / HeJ нет на месте

г
BIO.RKDB нет на месте

я
C57BL / Международная организация журналистов нет на месте
б

d

е

час

J
РИСУНОК 23,13 Для легенды см 650.

| MOUSE ГЕНЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ | ||||||
| В | ||||||
| Штамм | Ld ген | CD4+ ячейки | CD8+ ячейки | |||
| мышь | ||||||
| a | б |

BALB / с подарок

| с | d |
C3H.Ld подарок

| е | е |
C3H / HeJ нет на месте

| г | час |
BALB / c- нет на месте
Н-2дм2

| я | J |
C57BL / Международная организация журналистов нет на месте
РИСУНОК 23,13 Для легенды см 650.

| Иммунитет и АДАПТИВНАЯ генетика иммунного ответа хозяина | |||
| С | BALB / с | BALB / CH-2дм2 |

б актина
ТФР-б
- - - + + + - + + + - + + + + +
Фигура 23.13 (А) Характерные примеры мозгов устойчивых и восприимчивых штаммы мышей через 30 дней после пероральной инфекции. Устойчивый мышей с Ld Ген имел минимальное воспаление и бремя паразита, и восприимчивый мышей с LdГен имел большее воспаление и паразитарной нагрузки. Мозги устойчивость BALB / с (а, б) и C3H.Ld(В, г) мышей. Мозги восприимчивого C3H / HeJ (E, F), B10.RKDB (г, з), и C57BL / l0J (I, J) мышей. В (а) и (с), Н & Е-окрашенные срезы (×250) от резистентного мышея продемонстрировал лишь умеренные менингеальную и периваскулярное воспаление (отмечены стрелками). Эти цифры являются репрезентативными мягким воспалением градуированным как = 2 патологоанатомом. В (б) и (г), иммунопероксидазные окрашенные участки представитель резиста-муравьиного мышей не демонстрирует наличие Т. гондий тахизоитов или в мозговых оболочках или в ассоциации с судами. Стрелка в формуле (б) отмечает кисту Т. гондия, видно лишь изредка в разделах от резистентного мышея. В (е), (г) и (I), Н & Е-окрашенные участки (×250) от предрасположенных мышей продемонстрировали существенное менингеальные и perivas-сосудистые воспаления и, в отличие от цист-устойчивых штаммов, существует также значительное воспаление паренхимы (каждый отмечены стрелками). Эти цифры с большими количествами воспаления representa-TIVE тех, оценивались как = 3 патологоанатомом. В (е), (з), и (к), иммунопероксидазное пятно представительных срезов головного мозга от предрасположенного мышея показало, многие внеклеточные тахизоиты Т. гондий или bradyzoites (отмечен стрелками) в пределах очагов воспалительных клеток. Морфологически различны киста (например, в верхнем правом углу Ь и г) также были продемонстрированы и с и без сопутствующих воспалительных инфильтратов клеток. Результаты с BALB / CH-2дм2Мыши были похожи (данные не показаны). Поликлональные анти-Toxoplasma антисыворотка используется для окрашивания иммунопероксидазного распознает как тахизоиты и bradyzoites.