По современным взглядам, коррекция нарушений микробиоценоза должна проводиться в обязательном порядке и определяться возрастом пациента, характером основного заболевания, преморбидным фоном, типом вскармливания (питания), наличием или отсутствием аллергических проявлений (пищевой, лекарственной сенсибилизации), особенностями микробиологических нарушений, выявленных в ходе исследования посева фекалий. По нашему мнению, в случае выявления основной гастроэнтерологической патологии, сопровождающейся дисбиотическими нарушениями кишечника, следует придерживаться последовательной схемы ведения больного (рис. 29). Она заключается в следующем.
I. Установление основного заболевания, лечение пациента по поводу верифицированной патологии, включая лечебное питание и восстановление основных функций пищеварительной и/или других систем человеческого организма.
II. Восстановление микробиологического равновесия в кишечнике в ранний реабилитационный период излечения больного, страдающего желудочно-кишечным (или другим) заболеванием:
1) по строгим показаниям — подавление роста того или иного условно-патогенного микроорганизма (селективная деконтаминация);
2) для всех пациентов — избирательная стимуляция, направленная на активацию процессов роста и размножения собственной, эндогенной флоры (пребиотическая поддержка кишечника), и одновременное заместительное заселение кишечника нормальными представителями микрофлоры, создание временного искусственного биоценоза (пробиотическая поддержка).
Так, в случае обращения родителей пациента, особенно грудного и раннего возраста, к врачу с данными анализа кала на дисбактериоз или получение подобного заключения педиатром в связи с плановым обследованием ребенка это должно послужить поводом не для сиюминутной терапии выявленных микробиологических нарушений, а поиска причин, вызвавших эти отклонения. Кроме многочисленных гастроэнтерологических заболеваний к значительным нарушениям микробиоты кишечника могут приводить другие соматические болезни, ряд критических состояний раннего периода развития ребенка: бактериальный вагиноз и/или гнойный мастит у кормящей матери, нерациональное вскармливание, нахождение в закрытом коллективе с особой микроэкологией, необоснованное и нерациональное назначение антибактериальных средств, многообразие стрессовых ситуаций, отравления и т. д. (Кулагина Н. В., 1996; Фролова Н. А., 2001; Петерсон В. Д., 2004).
РИС. 29. Примерная схема реабилитации больного с гастроэнтерологической патологией и дисбиозом кишечника
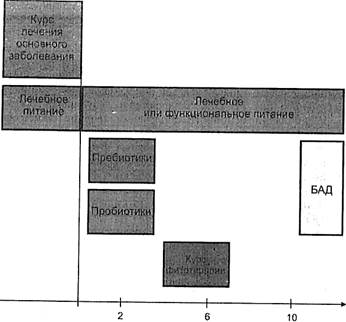
Вопросы установления и лечения больных с теми или иными за-болеваниями желудочно-кишечного тракта нами были освещены до-статочно подробно в предыдущих главах. В дальнейшем остановимся на рассмотрении практических вопросов восстановления микробио-логического равновесия флоры кишечника в реабилитационный период терапии больного, страдающего основным заболеванием.
В период лечения пациента раннего возраста, страдающего ка-ким-либо заболеванием, порой определенное значение приобретает селективная деконтаминация. Подавление роста того или иного условно-патогенного микроорганизма или селективная деконтаминация — наиболее сложный вопрос при решении проблемы кишечного дисбиоза. Однозначных ответов, к сожалению, теория и практика не дают. С одной стороны, часть специалистов активно лоббируют антибиотико- и химиотерапию, рассматривая их как основной компонент коррекции дисбиотических нарушений, с другой стороны, оппоненты абсолютизируют пре- и пробиотики, используя их как монотерапию даже при высокой патологической активности условно-патогенных микроорганизмов (Урсова Н. И., 2006).
Наше мнение заключается в поиске «золотой середины». Если лечение больного, страдающего основным заболеванием, дало положительный эффект, симптомы болезни нивелируются, общее самочувствие улучшается, то при обнаружении незначительных отклонений в анализе фекалий на дисбактериоз, даже с участием некоторых представителей условно-патогенной флоры, коррекция может начинаться сразу с назначения пре- и пробиотиков. Мы убеждены, что пищеварительный тракт, как и весь организм в целом, является самоорганизующейся системой, стремящейся к балансу (Шендеров Б. А., 1998), и «излишняя суета» только увеличит время восстановления микробиоты, а нерациональное использование антибактериальных средств, их побочные эффекты могут оказать организму «медвежью услугу».
На сегодня известны показания для проведения микробной де- контаминации кишечника, предшествующей назначению пробиотиков:
♦ наличие избыточного бактериального роста в тонкой кишке (при концентрации условно-патогенной флоры более 106 степени КОЕ/г);
♦ значимый воспалительный процесс в кишечнике, например эн-тероколит;
♦ устойчивое, неоднократное выявление вирулентных штаммов условно-патогенной микрофлоры в посевах фекалий.
В настоящее время в медицинской практике используют различные медикаментозные средства. Их можно условно подразделить на две группы-
1) антибактериальные средства, которые после приема внутрь не адсорбируются из кишечника и обеспечивают антимикробный эффект только в самом кишечнике, не оказывая общерезорбтивного действия. Их принято называть кишечными антисептиками. Это производные нитрофуранов, нефторированные хинолоны и хинолины, некоторые сульфаниламиды, аминогликозиды и т. д.;
2) антибиотики, которые хорошо всасываются из тонкой кишки, оказывают системное действие, но одновременно обеспечивают терапевтические концентрации в просвете кишечника: фторхинолоны, хлорамфеникол, нигроимидазолы и др.
При использовании антибактериальных средств отмечается подавляющее влияние как на условно-патогенную флору, так и нормальных представителей микробиоты. Особенно это касается второй группы лекарственных средств. Деконтаминация кишечника антибиотиками приводит к нарушению образования микробных пептидов ведущими представителями нормальной микрофлоры, а следовательно, к иммуносупрессии, подобно тому как это происходит при введении гидрокортизона (Шендеров Б. А., 1998). Поэтому в педиатрической практике достаточно широкое распространение получили препараты первой группы, обладающие селективным деконтаминационным эффектом (табл. 26) с учетом их антибактериального воздействия.
В качестве антибактериального воздействия и пробиотической поддержки довольно часто используют свойства некоторых сахаромицет и спорообразующих микроорганизмов для подавления избыточного кишечного роста, условно отнесенных к так называемым «антагонистически активными пробиотикам» (энтерол, бактисубтил и др.). Согласно современным взглядам, пробиотиками их можно назвать условно, так как такие средства не содержат типичных представителей нормальной микрофлоры кишечника. Общепризнанным антагонистически активным пробиотиком с доказанными свойствами является энтерол («Биокодекс Лаб.», Франция). Действующим ингредиентом этого лекарственного средства являются лиофилизированные Saccharomyces boulardii (250 мг). Эти микроорганизмы оказывают выраженное антимикробное действие, обусловленное антагонистическим эффектом в отношении патогенной и условно-патогенной микрофлоры (клостридий, кандид, клебсиелл, эшерихий и др.), обладают антитоксинным действием в отношении бактериальных цито- и энтеротоксинов, естественной устойчивостью к антибиотикам. После орального введения Saccharomyces boulardii проходят через пищеварительный тракт в неизменном виде без колонизации. Препарат полностью выводится из организма в течение 2-5 дней после прекращения приема. В основном детям энтерол 250 назначается при диареях любой этиологии: с 1 года до 3 лет по 1 капсуле 2 раза в день в течение 5 дней, от 3 лет и взрослым — по 1—2 капсуле 2 раза в день в течение максимально 7—10 дней. Энтерол следует принимать за час до еды, запивая небольшим количеством охлажденной жидкости. Для младенцев, а также в случаях затруднений глотания капсулу можно раскрыть и давать ее содержимое с холодной или чуть теплой жидкостью. Прием препарата для лечения острой диареи в обязательном порядке должен сопровождаться регидратацией.
Бактисубтил («Лаборатории Авентис», Франция) представляет собой капсулированную форму, включающую споры В. cereus IP 5832. Препарат основан на неспецифических для человека микроорганизмах. По современным требованиям ВОЗ он не может считаться полноценным средством для улучшения здоровья организма-хозяина. Стало известно, что бактисубтил обладает низкой эффективностью, не способен выполнять функции нормальной микрофлоры, быстро самоэлиминируется. В настоящее время применение его в клинической практике теряет свое значение.
Что касается применения для селективной деконтаминации бактериофагов, то сегодня в отношении этих средств существует противоречивое мнение. Бактериофаги обладают избирательной активностью только к определенным штаммам тех или иных микробов. Выявить ее можно с использованием сложных тестов на фаголизис, проверку на разрушение выделенных культур. Создание высококачественных бактериофагов достигается систематическим подбором штаммов с широкой валентностью и высокой силой ли- тического действия от больных и бактерионосителей, постоянным обновлением производственных культур за счет свежевыделенных. Одной из причин относительно низкой эффективности фагов является недостаточность знаний об условиях, необходимых для их оптимального взаимодействия с определенными видами бактерий. Фактором, лимитирующим эффективность фагов, является быстрое формирование резистентных микробов (в равной степени касается и антибиотиков), а также появление в организме антифаговых антител, что исключает возможность многократного введения фагов (Урсова Н. И., 2006). Кроме того, в нашей практике мы встречались с довольно частыми случаями аллергических реакций у детей раннего возраста на белковые компоненты среды бактериофаговых препаратов. Все эти сложности практически исключают возможность их широкого применения в современной практике. Поэтому для селективной деконтаминации с учетом показаний мы рекомендуем использовать кишечные антисептики (см. табл. 26).
В отличие от кандидоносительства при избыточном росте Candida spp. в количестве более 1000 КОЕ/г и одновременном снижении доли облигатной нормофлоры обязательно потребуется антимикотическая терапия (Шевяков М. А., 2000). Основной пре-
парат в данной ситуации пимацуфин («Яманучи Фарма», Италия),
действующим веществом которого является натамицин, назначае-
мый детям по 100 мг (1 таб.) 2 раза в сутки в течение 10 дней. Сис-
темные антимикотические препараты не показаны.
Пре- и пробиотическая поддержка кишечника — следующий этап тактики восстановительного лечения ребенка с желудочно-кишеч-
ной патологией. Восстановление микробиологического равнове-
сия кишечника в реабилитационный период является многосто-
ронней задачей. Пре- и пробиотическая поддержка микробиоты
кишечника осуществляется путем применения пребиотиков — ин-
гредиентов, которые избирательно стимулируют рост и/или ме-
таболическую активность бактерий и параллельно биологических
бактерийных препаратов на основе микроорганизмов — предста-
вителей нормальной микрофлоры человека (пробиотиков). По-
добная тактика на современном этапе развития науки оправданна
и показала свою высокую эффективность (Шендеров Б. А., 2001;
Урсова Н. И., 2006; Калмыкова А. И. и соавт., 2007; Денисов М. Ю.,
2008).
Для проведения восстановительной поддержки пищеваритель-
ного тракта врачу следует оценить все факторы и соблюсти следу-
ющие условия:
1) пре- и пробиотическая терапия должна проводиться в период
«затухающего» обострения или реконвалесценции основно-
го заболевания, когда основная симптоматика болезни ми-
нимальна, завершено большинство курсов медикаментозных
средств;
2) функциональная способность желудочно-кишечного тракта
должна быть восстановлена: у ребенка отсутствует абдо-
минальный болевой синдром (кишечные колики), нет задерж-
ки или значительного учащения акта дефекации, диспептиче-
ские симптомы минимальны или отсутствуют;
3) объем терапии должен включать в себя нутритивную поддер-
жку (функциональное питание), курсы пре- и пробиотиков,
фитотерапию;
4) бережно относиться к пациенту, избегать полипрагмазии
и необоснованного использования тех или иных средств ле-
чения;
5) реабилитация ребенка должна быть комплексной, пролонги-
рованной, с дальнейшим переходом к стратегии профилакти-
ки заболеваний, нарушений микробиологического равновесия.
Пребиотики являются специальными ингредиентами, которые избирательно стимулируют рост и/или метаболическую активность одной или нескольких групп бактерий, обитающих в кишечнике, приводя к нормализации их соотношения. Классическими пребиотиками являются сложные углеводы, не расщепляющиеся в верхних отделах желудочно-кишечного тракта, способные благотворно и многогранно действовать на организм ребенка. По мере продолжительности их применения возникают различные физиологические процессы: селективная стимуляция роста или усиление метаболической активности нормальной микрофлоры кишечника, стимуляция секреции муцина, нормализация иммунологического гомеостаза и кишечной моторики (Stark P. L. et al., 1982). Большая часть таких углеводов представлена олигосахаридами — это фруктоолигосахариды (ФОС), галактоолигосахариды (ГОС). Эти вещества содержатся в продуктах растительного происхождения: кукурузных хлопьях, крупах, хлебе, чесноке, фасоли, горохе, артишоке, аспарагусе и т. д. Наиболее изученными являются олигосахариды (Украинцев С. Е. и соавт., 2004; Нетребенко О. К., 2007). В женском грудном молоке олигосахариды являются второй по значимости группой углеводов, их концентрация достигает 1 г на 100 мл. Это наиболее важный фактор для нормального становления микробиоты у детей грудного возраста (Трачук Т. Ю., Шраер О. Т., 1999). В животном молоке их доля минимальна. Поэтому ФОС и ГОС обычно включают в продукты питания (современные смеси) младенцев, находящихся на искусственном вскармливании.
Инулин — органическое вещество из группы полисахаридов, полимер D-фруктозы. В литературе его иногда относят к группе растворимых пищевых волокон. В клубнях и корнях георгины, нарцисса, гиацинта, туберозы, цикория и земляной груши (топинамбура) содержание инулина достигает 10-12 %. В растениях вместе с инулином почти всегда встречаются родственные углеводы, также являющиеся пребиотиками, — псевдоинулин, инуленин, левулин, гелиантенин, синистрин, иризин и др., дающие, как и сам инулин, при гидролизе D-фруктозу. Легко усваивается организмом человека, в связи с чем применяется в медицинской практике с давних времен как заменитель крахмала и сахара при сахарном диабете. Он служит исходным материалом для промышленного получения фруктозы. В последние годы доказаны его пребиотические свойства за счет D-фруктозы, что повлияло на включение инулина в состав продуктов функционального питания.
В качестве лекарственных средств — пребиотиков в медицинской практике чаще всего используется изомер лактозы — лактулоза. Это синтетический дисахарид, который давно известен в микробиологии, где применяется для составления питательных сред. В человеческом организме он не подвергается гидролизу в верхнем отделе пищеварительного тракта из-за отсутствия специфического фермента. Попадая в толстую кишку в неизмененном виде, она расщепляется кишечной микрофлорой на органические кислоты с короткой цепью (уксусная, масляная, яблочная, пропионовая и др.). При высоких концентрациях лактулозы образуется значительное количество кислот, происходит понижение рН, повышение осмотического давления и как следствие увеличение объема кишечного содержимого, что, в свою очередь, усиливает перистальтику и изменяет консистенцию кала. В высоких дозах (300-700 мг/кг массы тела в сутки) препараты лактулозы используются для коррекции нарушений дефекации, например при запорах, о чем было изложено в соответствующей главе.
Препараты лактулозы в России представлены такими лекарственными средствами, как нормазе («JI. Молтени и К. деи Фрателли Алитти Сочиета ди Езерчицио С. п. А.», Италия), дюфалак («Сол- вей Фармасьютикалз Б. В.», Нидерланды) и порталак («Белупо, лекарства и косметика, д. д.», Хорватия). В педиатрической практике чаще всего используются нормазе и дюфалак, представляющие собой 66,7 %-ный сироп лактулозы. В качестве пребиотического средства лактулоза назначается в низких дозах, предельным в этом случае считается такое количество препарата, которое не вызывает учащения стула. Кратность приема препарата 1—2 раза в сутки, курс 1—2 мес. (табл. 27).