Клетки сердечной мышцы подразделяется на сократительные кардиомиоциты, которые образуют предсердия и желудочки (миокард), и клетки синусного узла и проводящей системы сердца, которые генерируют и проводят электрические импульсы в сердце к кардиомиоцитам и не обладают сократительной способностью.
 |
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
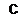 | |||
 |
|
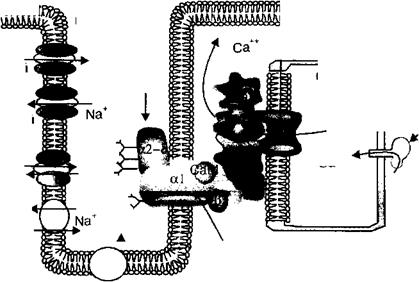
Дигидропиридиновый рецептор сарколеммы и рианодиновый рецептор мембраны саркоплазматического ретикулума представляют собой кальциевые ионные каналы и непосредственно связаны между собой кальмодулином (СаМ). Деполяризация сарколеммы t-трубочек вызывает последовательное открытие потенциалзависимых кальциевых ионных каналов сарколеммы и при участии кальмодулина — саркоплазматического ретикулума. Открытие ионных каналов ретикулума вызывает выход ионов Са2+ в саркоплазму, что является триггером механизма сокращения кардиомиоцитов.
Сердечная мышца является поперечно-полосатой, однако ее сократительная способность, в отличие от скелетной мышцы, характеризуется синхронностью сокращения и расслабления всего миокарда. Синхронность сокращения и расслабления сердечных мышечных клеток обусловлена наличием специализированных плотных контактов между ними, или так называемых нексусов. Плотный контакт представляет собой участок мембраны двух кардиомиоцитов, в пределах которого мембраны прилегающих кардиомиоцитов сливаются между собой, эти плотные контакты является местом низкого электрического сопротивления между клетками и представляют, таким образом, путь электротонического распространения потенциала действия от одного кардиомиоцита к другому. Эта структурная особенность сердечной мышцы способствует быстрому распространению электрической активности, т. е. потенциала действия в миокарде. Понятие функциональный синцитий обычно относят к сердечной мышце, чтобы показать, что сердце является единым в функциональном отношении органом в результате взаимодействия отдельных сердечных мышечных клеток. Кардиомиоциты объединены в функциональный синцитий благодаря низкому сопротивлению нексусов, с помощью которых осуществляются контакт между миоцитами и передача потенциала действия от одного миоцита к другому. В результате потенциал действия из центра синоатриального узла достигает всех сердечных мышечных клеток, вызывая сокращение предсердий и желудочков
Кардиомиоциты имеют как сходные черты в своем строении со скелетными мышечными клетками, так и отличия. Взаимное расположение филаментов актина и миозина в саркомерах придает поперечную исчерчен- ность сердечным мышечным клеткам. Рядом расположенные миоциты отделены друг от друга на их концах вставочными дисками. Диски являются местом проведения потенциала действия в сердечной мышце. Сердечная мышечная клетка содержит одно ядро; t-система ее сарколеммы примерно в два раза шире, чем в скелетном мышечном волокне, и t-трубочки локализованы ближе к Z-линии саркомеров, саркоплазматический ретикулум контактирует с t-системой и с сарколеммой (рис. 2.39). Саркоплазматический ретикулум представляет собой замкнутую систему трубочек, ветвящихся в пределах кардиомиоцита и содержащих ионы кальция. Саркоплазматический ретикулум кардиомиоцитов, как депо ионов Са2+, играет основную роль сопряжения процессов возбуждения и сокращения в сердечной мышце.
2.8.1. Электрическая активность клеток сердечной мышцы
2.8.1.1. Потенциал покоя
Потенциал покоя в разных типах сердечных мышечных клеток изменяется в пределах от —60 до —90 мВ: он меньше в атипических клетках проводящей возбуждение системы сердца и больше в сократительных сердечных клетках предсердий и желудочков. Механизм происхождения мембранного потенциала покоя в сердечных мышечных клетках является таким же, как и для всех клеток организма, и зависит от высокой внутриклеточной и низкой внеклеточной концентрации ионов калия, а также низкой проницаемости саркоплазмы для ионов натрия. Мембранный потенциал сердечных мышечных клеток приближается к равновесному калиевому потенциалу (Ej<). Однако потенциал покоя большинства кардиомиоцитов равен -80 мВ. Мышечные клетки синоатриального узла и клетки проводящей систе-
мы сердца имеют меньший, чем кардиомиоциты мембранный потенциал, амплитуда которого находится в пределах —60—70 мВ. Поэтому клетки синоатриального узла имеют более низкий порог возбудимости, чем кардиомиоциты, что обусловлено так называемыми внутренними свойствами мембраны синоатриальных клеток.
Электрогенный Na+/K+-Hacoc в кардиомиоцитах участвует в формировании 5—10 % нормальной величины потенциала покоя на мембране клеток сердца, что составляет в среднем —10—11 мВ. Это обусловлено тем, что плотность Na+/K+-АТФазы в области t-трубочек мембраны кардиомиоцитов выше, чем в других участках их сарколеммы. В отличие от скелетных мышечных клеток, в кардиомиоцитах физиологическая роль Na+/K+- насоса является ведущей в поддержании постоянной величины потенциала покоя на мембранах клеток и, следовательно, физиологического уровня их возбудимости. Данное обстоятельноство обусловлено тем, что инактивация натриевых (а также кальциевых) ионных каналов и их способность участвовать в генерации потенциала действия в сердечных мышечных клетках зависит от величины максимального потенциала покоя сердечных клеток в диастолу. В клетках сердца одной из важных функций Na+/K+-Hacoca является создание максимальной величины потенциала на мембране сердечных мышечных клеток в диастолу, что исключает колебания потенциала покоя кардиомиоцитов и формирует у клеток постоянный исходный уровень возбудимости.
2.8.1.2. Молекулярный механизм потенциала действия в типичных сердечных мышечных клетках
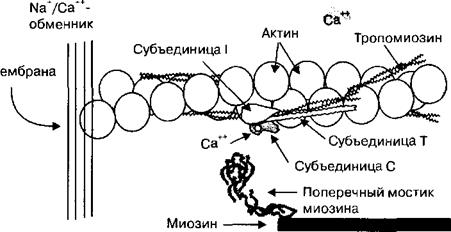
Потенциал действия кардиомиоцитов имеет большую продолжительность: до 200 мс в миоцитах предсердий, до 400 мс в клетках желудочков сердца. Потенциал действия кардиомиоцитов состоит из фазы деполяризации, фазы плато и фазы реполяризации (рис. 2.40). Изменение мембранного потенциала сердечных мышечных клеток во время генерации в них потенциала действия обусловлено трансмембранными токами ионов Na+, Са2+ и К+.
Фаза деполяризации потенциала действия в кардиомиоците. Потенциал действия на мембране кардиомиоцита возникает под влиянием возбуждения атипичных мышечных клеток проводящей системы сердца. При этом потенциал действия распространяется по проводящей системе сердца до волокон Пуркинье. Между мембранами волокон Пуркинье и кардиомиоцитами имеются плотные вставочные диски, или нексусы. Реверсия потенциала на мембране волокон Пуркинье электротонически при участии вставочных дисков вызывает деполяризацию мембранного потенциала кардиомиоцита до порога возбуждения (£к), который для кардиомиоцитов составляет —60 мВ. С этого момента по закону «все или ничего» в мембране кардиомиоцитов открываются быстрые потенциалзависимые натриевые ионные каналы. Ионы натрия через открытые каналы по концентрационному градиенту устремляются внутрь кардиомиоцита, сдвигая его мембранный потенциал в сторону равновесного натриевого потенциала (Е^а составляет +70 мВ) и происходит перезарядка мембраны сердечных сократительных клеток. Деполяризация сердечных мышечных клеток развивается чрезвычайно быстро, и на мембране кардиомиоцитов за 2 мс потенциал достигает +30 мВ. В фазу деполяризации при открытых быстрых натриевых ионных каналах мембраны кардиомиоциты утрачивают свою возбудимость (абсолютная рефрактерность), и сократительные клетки миокарда не
Мембранный потенциал (мВ)
Время (мс)
Рис. 2.40. Потенциал действия кардиомиоцтита. В происхождении потенциала действия кардиомиоцита участвуют натриевые, кальциевые и калиевые ионные токи.
В фазу деполяризации (1) открываются потенциалзависимые натриевые каналы и мембранный потенциал резко уменьшается за счет входящего натриевого тока. Натриевые каналы через несколько миллисекунд закрываются и открываются потенциалзависимые калиевые ионные каналы, что вызывает начало реполяризации мембраны кардиомиоцита (2). Поскольку под влиянием деполяризации открываются потенциалзависимые кальциевые ионные каналы, то входящий кальциевый ток в фазу реполяризации уравновешивает выходящий калиевый ток и возникает фаза плато (3). После закрытия кальциевых ионных каналов выходящий калиевый ток реполяризует (4) мембранный потенциал до исходного уровня (Em).
способны реагировать даже на сверхпороговое раздражение. Деполяризация в сердечных мышечных клетках прекращается под влиянием двух процессов: 1) быстрые натриевые каналы закрываются через несколько миллисекунд после открытия; 2) открываются потенциалзависимые калиевые ионные каналы. В результате на мембране кардиомиоцитов начинает доминировать калиевый ток (1к). Оба фактора — закрытие быстрых натриевых ионных каналов и открытие калиевых каналов — вызывают уменьшение положительного потенциала на мембране кардиомиоцитов, и начинается фаза реполяризации мембранного потенциала. В кардиомиоцитах в отличие от скелетных мышечных клеток фаза реполяризации имеет отличительную особенность — она прерывается фазой плато потенциала действия, длительность которой обусловливает общее время периода абсолютной рефрактерности сердечной мышцы.
Фаза плато потенциала действия в кардиомиоцитах является уникальной особенностью потенциала действия кардиомиоцитов. Фаза плато потенциала действия в кардиомиоцитах представляет собой задержку процесса реполяризации положительного потенциала, обусловленную появлением в этот момент генерации потенциала действия кардиомиоцита входящего кальциевого тока. Основной причиной возникновения входящего кальциевого тока является деполяризация потенциала на мембране сердечных сократительных клеток. Деполяризация потенциала на мембране кардиомиоцитов открывает L-тип потенциалзависимых кальциевых ионных каналов. В результате в мембране клеток увеличивается проницаемость для ионов Са2+, которые по концентрационному градиенту входят внутрь кардиомиоцитов. Кальциевые ионные каналы в мембране кардиомиоцитов остаются открытыми в среднем 200 мс (варьирует от 150 до 400 мс) и, таким образом, обусловливают длительность фазы плато. Мембранный потенциал в фазу плато сохраняется на относительно постоянной величине, поскольку входящий кальциевый ток уравновешивается выходящим калиевым. Время фазы плато обусловливает продолжительность периода абсолютной рефрактерности сердечной мышцы, которая у человека является невозбудимой структурой на протяжении порядка 270 мс. Кардиомиоциты имеют абсолютную рефрактерность на протяжении почти всей систолы (0,3 с). Это создает идеальные физиологические условия для проявления сократительных свойств всей сердечной мышцы, которая в этих условиях сокращается по типу одиночного мышечного сокращения и осуществляет, таким образом, выброс крови в аорту и легочные артерии из желудочков сердца.
Фаза реполяризации потенциала действия в кардиомиоцитах. Фаза плато оканчивается в результате закрытия кальциевых ионных каналов и увеличения калиевого тока. Поэтому выходящий калиевый ток (1К) снижает потенциал на мембране кардиомиоцитов в течение порядка 50 мс до —90 мВ. В фазу реполяризации в кардиомиоцитах уменьшается количество инактивированных натриевых ионных каналов и они способны реагировать на сверхпороговые раздражения. Это состояние сердечной мышцы называется относительной рефрактерностью. Когда потенциал на мембране кардиомиоцитов уменьшается до своей исходной величины, закрываются потенциалзависимые калиевые ионные каналы, а натриевые потенциалзависимые ионные каналы переходят в закрытое состояние. С этого момента кардиомиоциты имеют исходный уровень возбудимости и способны реагировать на очередной импульс, исходящий от клеток проводящей системы сердца.
2.8.1.3. Механизм возникновения пейсмекерной активности в клетках синоатриального узла
Частота сокращения сердечных мышечных клеток предсердий и желудочков сердца обусловлена частотой генерации потенциалов действия клетками синусного узла. Синоатриальный узел расположен в задней стенке правого предсердия в месте его соединения с верхней полой веной и состоит из небольших сердечных мышечных клеток, которые не способны сокращаться.
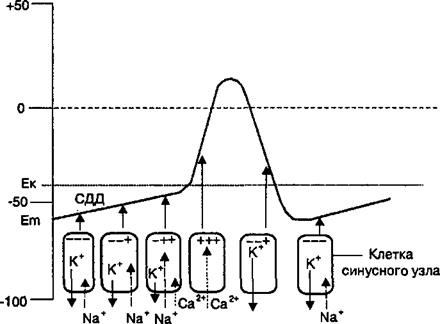
Пейсмекерные потенциалы. Мембранный потенциал клеток синоатриального узла равен примерно —60 мВ. В интервале времени между генерацией потенциалов действия (в фазу диастолы сердца) мембранный потенциал синоартриальных мышечных клеток постепенно уменьшается до критического уровня деполяризации (порядка —40 мВ). Медленная деполяризация мембранного потенциала синоатриальных мышечных клеток, поскольку она совершается в фазу диастолы сердца, называется спонтанной диастолической деполяризацией и заканчивается генерацией пейсмекерного потенциала при достижении критического уровня деполяризации этих клеток (рис. 2.41).
Механизм возникновения пейсмекерного потенциала в синоатриальных мышечных клетках связан с ролью натриевого, калиевого и кальциевого ионных токов. Два ионных тока (7№+ и 1Са2+) направлены внутрь клеток синоатриального узла и вызывают деполяризацию их мембраны. Наибольшее
Мембранный потенциал (мВ)
0 200 400 600 800
Время (мс)
Рис. 2.41. Основные ионные токи калия, натрия и кальция, участвующие в генерации пейсмекерного потенциала и потенциала действия клеток синоатриального узла.
Внутренним свойством мембраны пейсмекерных клеток синоатриального узла является ее спонтанная деполяризация, которая, достигая критического уровня (Ек), вызывает на ее мембране генерацию потенциала действия. Стрелками обозначено направление входящих токов (натрия, Кальция) и выходящего калиевого тока в период спонтанной деполяризации мембраны и генерации потенциала действия клетки синоатриального узлаатри. Длина стрелок условно отражает величину трансмембранных токов этих ионов. СДД — спонтанная диастолическая деполяризация.
значение в появлении пейсмекерного потенциала имеет входящий натриевый ток через специфические натриевые каналы, которые открываются реполяризацией мембраны синоатриальных мышечных клеток. Финальная фаза пейсмекерного потенциала, т. е. приближение его амплитуды к критическому уровню деполяризации мембраны в клетках синоатриального узла, связана с открытием Т-типа потенциалзависимых кальциевых ионных каналов и появлением входящего кальциевого тока. Входящие натриевый и кальциевый токи (спонтанная деполяризация) противодействуют выходящему калиевому току, который гиперполяризует мембрану синоатриальных мышечных клеток (см. рис. 2.41). В этих условиях под влиянием токов ионов Na+ и Са2+ деполяризация мембраны синоатриальных мышечных клеток достигает критического уровня деполяризации и в клетках синоатриального узла генерируется очередной потенциал действия, который распространяется по проводящей системе сердца и является раздражителем для сократительных сердечных клеток сердца.
Частота генерации потенциалов действия в синоатриальных мышечных клетках зависит от скорости деполяризации пейсмекерного потенциала. В отсутствии влияний со стороны вегетативной нервной системы на клетки синоатриального узла, частота генерации потенциалов действия составляет в среднем 2 в секунду (120/мин).
Клетки, расположенные в центре синоатриального узла, имеют большую скорость развития пейсмекерного потенциала и высокую частоту генерации потенциалов действия. Клетки периферических областей узла имеют более медленные изменения пейсмекерных потенциалов, но большее число миофиламентов. Таким образом, это обусловливает постепенный переход в свойствах миоцитов от пейсмекерных клеток центральной области синоатриального узла к свойствам, присущим сократительным предсердным мышечным клеткам. Частота сокращения сердца в покое (порядка 70 в минуту) обусловлена тормозным действием блуждающего нерва на пейсмекерные клетки центральной области синоатриального узла.
2.8.2. Молекулярный механизм сокращения кардиомиоцитов
Механизм сокращения сердечных мышечных клеток в основном идентичен таковому в скелетных мышечных клетках. Ионы Са2+ являются «ключом» к сокращению миокарда, поскольку они выполняют связующую функцию между деполяризацией мембраны кардиомиоцитов, вызванной распространяющимся потенциалом действия по их поверхности, и укорочением саркомеров в сократительных клетках сердца. Концентрация ионов Са2+ в саркоплазме невозбужденного кардиомиоцита составляет 0,1 пМ/л (менее 10-7 М/л). Во время деполяризации мембраны сарколеммы и t-сис- темы кардиомиоцитов внутриклеточная концентрация ионов Са2+ достигает 1—10 мкмМ/л (более 10-6 М/л) в результате появления входящего кальциевого тока.
Увеличение ионов кальция в саркоплазме кардиомиоцитов активирует так называемую сократительную машину сердца. Взаимодействие ионов Са2+ с тропонином, когда изменяется положение тропомиозина, закрывающего места связывания на актиновом филаменте для поперечных мостиков миозина, является центральным процессом в электромеханическом сопряжении, как в скелетной мышце, так и в сердечной. В кардиомиоцитах ионы кальция связываются с субъединицей С тропонина тропомиозинового комлекса. Связывание ионов Са2+ с тропонином С уменьшает плотность электростатической связи тропонина Т и тропомиозина относительно тонких филаментов и тропомиозиновый комплекс, смещаясь с периферической части глобулярного актина в зону контакта двух белковых нитей спирали актинового филамента, открывает на нем места связывания головок поперечных мостиков миозина с актином. В отличие от скелетной мышцы, в кардиомиоцитах концевая 1ЧН2-область тропонина С содержит только одно место связывания ионов Са2+. Поэтому, даже при максимальной концентрации ионов Са2+ в цитозоле кардиомиоцитов, не происходит полной активации ионами Са2+ тропонина С, что не приводит к открытию всех мест связывания поперечных мостиков с актиновыми филаментами. Это создает потенциальные условия в кардиомиоцитах для дополнительной активации сократительной способности сердечной мышцы уже непосредственно в процессе сокращения миокарда. Например, под влиянием циклических процессов «замыкание—сокращение—размыкание» поперечных мостиков миозина дополнительно увеличивается связывание ионов Са2+ с тропонином С. Сила сокращения, генерируемая поперечными мостиками миозина в кардиомиоцитах сердца, прямо зависит от внутриклеточной концентрации ионов Са2+ во время фазы плато потенциала действия.
В электромеханическом сопряжении сердечных мышечных клеток участвуют два рецепторных белка: потенциалзависимый дигидропиридиновый рецептор мембраны t-трубочек и рианодиновый рецептор мембраны саркоплазматического ретикулума. Оба белка являются медленными кальциевыми ионными каналами. Деполяризация мембраны кардимиоцитов при распространении по их мембране потенциала действия открывают потенциалзависимые кальциевые ионные каналы мембраны t-трубочек. Ионы кальция по концентрационному градиенту поступают внутрь кардиомиоцитов и связываются с кальмодулином, расположенным на рианодиновом рецепторе или кальциевом ионном канале саркоплазматического ретикулума. Белок кальмодулин открывает кальциевые ионные каналы саркоплазматического ретикулума, и концентрация ионов Са2+ в саркоплазме повышается до пороговой (примерно 1 мкМ/л). Кальмодулин осуществляет взаимодействие в кардиомиоцитах между дигидропиридиновыми рецепторами мембраны t- трубочек и рианодиновыми рецепторами мембраны саркоплазматического ретикулума, за счет его активации внеклеточными ионами Са2+. Поэтому в сократительных клетках сердца процесс элеткромеханического сопряжения обусловлен ионами Са2+ внеклеточной среды. Электромеханическое сопряжение в кардиомиоцитах отсутствует при пониженной концентрации ионов Са2+ в интерстициальной среде, несмотря на нормальное их содержание в саркоплазматическом ретикулуме кардиомиоцитов.
Открытие кальциевых ионных каналов саркоплазматического ретикулума в кардиомиоцитах при участии белка кальмодулина вызывает выход этих ионов в межфибриллярное пространство кардиомиоцитов.
Наибольшая активация сокращения кардиомиоцитов происходит при концентрации ионов Са2+ в саркоплазме порядка 10 мкМ/л. В кардиомиоцитах имеет место так называемое Са2+-индуцированное высвобождение ионов Са2+, проявляющееся в том, что во время фазы плато потенциала действия ионы Са2+ входят в саркоплазму кардиомиоцитов через медленный кальциевый ионный канал дигидропиридинового рецептора. Далее ионы Са2+ связываются с медленным рианодиновым рецептором мембраны саркоплазматического ретикулума. При этом открытие одного Са2+-канала является сигналом для открытия других кальциевых каналов эндоплазматической сети. В результате из саркоплазматического ретикулума в цитоплазму кардиомиоцитов поступает нарастающее количество ионов Са2+, что существенно увеличивает силу сокращения сердечной мышцы.
2.8.3. Молекулярный механизм расслабления кардиомиоцитов
Их расслабление происходит во время фазы реполяризации потенциала действия и вызывается снижением внутриклеточной концентрации ионов Са2+. Процесс расслабления кардиомиоцитов обусловлен остановкой входящего кальциевого тока и прекращением высвобождения ионов Са2+ из саркоплазматического ретикулума. Основным механизмом расслабления миокарда является первично активный транспорт ионов Са2+ из саркоплазмы клеток в саркоплазматический ретикулум при участии Са2+-АТФазы кардиомиоцитов. Ионы Са2+ выводятся из саркоплазмы кардиомиоцитов в интерстициальную среду с помощью Ка+/Са2+-обменника. В результате их концентрация в межфибриллярном пространстве становится ниже порога активации тропонина С и тропонин-тропомиозиновый комплекс закрывает места связывания на актиновых филаментах для поперечных мостиков миозина. Миокард расслабляется, что соответствует фазе диастолы сердечного цикла.
Ключевым регулятором расслабления миокарда является белок мембраны саркоплазматического ретикулума фосфоламбан. Фосфорилирование фосфоламбана при участии вторичного посредника цАМФ ускоряет гидролиз АТФ, активирует кальциевый насос саркоплазматического ретикулума, повышает сродство ионов Са2+ к Са2+-АТФазе, увеличивая скорость активного транспорта ионов Са2+ из саркоплазмы внутрь саркоплазматического ретикулума. Благодаря функции фосфоламбана сродство ионов кальция и кальциевого насоса в кардиомиоцитах идентично таковому в быстрых скелетных мышечных волокнах, в которых отсутствует этот белок. Фосфоламбан увеличивает кальциевую чувствительность Са2+-АТФазы саркоплазматического ретикулума при взаимодействии адреналина или норадреналина с Pi-адренорецепторами мембраны кардиомиоцитов. Положительный инотропный эффект, возникающий при стимуляции этого типа рецепторов адреналином или норадреналином, проявляется в активации как сокращения миокарда, так и расслабления. Сила сокращения сердечной мышцы возрастает при увеличении скорости выхода ионов Са2+ из саркоплазматического ретикулума в саркоплазму и связывания с тропонином С. Расслабление миокарда прямо зависит от скорости депонирования ионов Са2+ в саркоплазматический ретикулум при участии фосфоламбана.
2.8.4. Медиаторный контроль сокращения кардиомиоцитов
В физиологических условиях механизмы сокращения сердечных мышечных клеток контролируются адрено- и холинорецепторами, расположенными на мембране кардиомиоцитов.
Из трех типов адренорецепторов (а1А, а1В и a1D) в сердце человека доминирует а1А тип, а также Р-адренорецепторы. Стимуляция (^-адренорецепторов увеличивает сократимость кардиомиоцитов и в целом ~ силу сердечных сокращений. Влияние стимуляции адренорецепторов на силу сокращения сердечной мышцы называется инотропным эффектом (лат. inos — сила). Молекулярный механизм инотропного эффекта норадреналина, вызванный стимуляцией cq-адренорецепторов, опосредован активацией системы G-белков (семейство Gq/n, обозначаемое как семейство Gh для сердца человека) с последующим образованием в кардиомиоцитах инози- тол-3-фосфата и диацилглицерола. Эти вторичные посредники через рианодиновые рецепторы мембраны саркоплазматического ретикулума увеличивают активность кальциевых ионных каналов, что повышает концентрацию ионов кальция в саркоплазме кардиомиоцитов и усиливает силу их сокращения. Кроме того, стимуляция cq-адренорецепторов увеличивает кальциевый ток через сарколемму внутрь кардиомиоцитов из внеклеточной среды, а также чувствительность сократительных миофиламентов к ионам Са2+. Функция а2-адренорецепторов в контроле физиологических свойств кардиомиоцитов человека связана с пресинаптическим торможением выделения норадреналина из нервных окончаний, иннервирующих сердце.
Из трех типов p-адренорецепторов в сердце человека идентифицированы рг и р2-адренорецепторы. Молекулярный механизм стимуляции сокращения миоцитов в сердце человека при участии рг и р2-адренорецепторов осуществляется при участии семейства Gs-белка, который повышает внутриклеточное содержание аденилатциклазы и вторичного посредника цАМФ. Это ведет к стимуляции фосфорилирования внутриклеточных белков при участии протеинканазы А, включая L-тип кальциевых ионных каналов мембран t-системы. В результате открытия кальциевых ионных каналов увеличивается содержание этих ионов в саркоплазме и, как следствие, возрастает сократимость сердечной мышцы (положительный инотропный эффект). В различных тканях организма человека идентифицировано пять генов, контролирующих синтез мускариновых М,—М5 рецепторов. При этом в сердце человека, локализован М2 тип холинорецепторов. Взаимодействие ацетилхолина с М2 (а также М4) типом холинорецепторов через семейство Gi/Go белков угнетает аденилатциклазу миоцитов и уменьшает активность калиевых и кальциевых ионных каналов, активируя фосфолипазу Д2, фосфолипазу D и протеинкиназы. В результате снижается скорость развития пейсмекерного потенциала в клетках синоатриального узла и уменьшается сократимость миокарда. Ацетилхолин через М2 холиноре- цепторы уменьшает сократимость кардиомиоцитов, если исходный уровень их сократимости был повышен под влиянием стимуляции р-адрено- рецепторов.
II РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Организм человека представляет собой сложную саморегулирующуюся иерархическую систему, которая обменивается с окружающей средой веществом, энергией и информацией. В ходе непрерывного взаимодействия со средой организм проявляет себя как реактивная система, приспосабливающая свои физиологические процессы к меняющимся условиям среды для уравновешивания с ней (гомеостазис), и одновременно как активная система, изменяющая среду в собственных целях и для удовлетворения своих потребностей (поведение). Как в том, так и в другом случае необходима интеграция всех иерархических уровней организации живой системы: молекулярного, субклеточного, клеточного, тканевого, органного. Согласование биофизических, биохимических и физиологических процессов, происходящих в тканях и органах, а также приспособление этих процессов к изменяющимся условиям внешней среды осуществляют регулирующие и управляющие системы организма: нервная и эндокринная.
Под регуляцией в физиологии понимается активное управление функциями биологической системы (вплоть до организма в целом и его поведения) с целью поддержания оптимального уровня ее жизнедеятельности и приспособления системы к меняющимся условиям внешней среды.
Изменение параметров функций при поддержании их в границах гомеостазиса происходит на каждом уровне организации или в любой иерархической системе за счет саморегуляции, т. е. внутренних для системы механизмов управления жизнедеятельностью. Так, например, уменьшение кровоснабжения ткани ведет к образованию в ней химических веществ, расширяющих артерии и восстанавливающих тем самым приток крови. Такие механизмы саморегуляции получили название местных.
Для осуществления функций организма в целом необходимы взаимосвязь и взаимозависимость функций составляющих его систем. Поэтому наряду с внутренними механизмами саморегуляции систем в организме должны существовать и внешние для каждой из них механизмы регуляции, соподчиняющие и координирующие деятельность систем. Например, для реализации функции перемещения тела человека в пространстве необходимо изменение деятельности не только скелетных мышц, но и кровообращения, дыхания, обмена веществ и т. п. Изменения параметров этих функций реализуются под влиянием сформировавшейся в процессе эволюции специализированной системы регуляции функций.
Однако и организму в целом присуща саморегуляция жизненных процессов, позволяющая осуществлять приспособление к меняющимся условиям существования. Организм является самоорганизующейся системой, т. е. сам выбирает и поддерживает значения огромного числа параметров функций, меняет их в зависимости от собственных потребностей, что позволяет ему обеспечивать наиболее оптимальный характер функционирования. Так, например, при низких температурах внешней среды организм снижает температуру поверхности тела (чтобы уменьшить теплоотдачу), повышает скорость окислительных процессов во внутренних органах и мышечную активность (чтобы увеличить теплообразование). Одновременно реализуется и адаптивное поведение — человек утепляет жилище, меняет одежду (для увеличения теплоизолирующих свойств), причем делает это даже заранее, опережающе реагируя на изменения внешней среды.
Основой физиологической регуляции является передача и обработка информации. Под термином «информация» следует понимать все, что несет в себе отражение фактов или событий, которые произошли, происходят или могут произойти. Информация содержит количественные характеристики определенных параметров внешней и внутренней среды организма, поэтому особую важность имеет ее объем. Примером способа количественного выражения информации, принятого в информатике как науке и используемого в организме, является двоичная система. Единицей количества в таком случае является бит, характеризующий информацию, получаемую при выборе одного из двух одинаково вероятных состояний, например да—нет, все—ничего, быть—не быть и т. п. Материальным носителем информации является сигнал, в форме которого и передается информация. Это могут быть как физические, так и химические сигналы, например электрические импульсы, форма молекулы, концентрация молекул и т. д. В тех случаях, когда регуляторным сигналом являются электрические импульсы (нервные потенциалы), регуляция функций осуществляется нервной системой. В случаях, когда регуляторный сигнал представлен химическими молекулами, находящимися в жидкостях внутренней среды, регуляцию называют гуморальной. Она осуществляется либо тканевыми метаболитами, либо специальной эндокринной системой.
Центральная нервная система обеспечивает согласованное взаимодействие органов и частей организма, участвующих в той или иной его реакции на воздействие среды, и формирует поведение, направленное на удовлетворение потребностей и преобразование среды. Центральная нервная система постоянно получает информацию об изменениях среды и может немедленно запускать в ответ на них врожденный комплекс стандартных приспособительных реакций — рефлексов, проявляющихся мышечными сокращениями или секрецией желез.
Сокращениями скелетных мышц управляет соматическая нервная система, посредством которой регулируются не только рефлекторные мышечные реакции, но и произвольные сокращения мышц, необходимые для активного взаимодействия человека со средой. Вегетативная нервная система иннервирует гладкие мышцы внутренних органов, сердце и железы внешней секреции; она осуществляет нервную регуляцию параметров внутренней среды организма. Регуляторная функция вегетативной нервной системы в отличие от соматической непосредственно не контролируется сознанием и осуществляется непроизвольно. Однако нервные центры головного и спинного мозга координируют активность соматической и вегетативной нервной системы и согласуют друг с другом их ответные реакции.
Эндокринные железы, или железы внутренней секреции, выделяют в кровь гормоны — химические вещества, предназначенные для передачи специфических управляющих сигналов другим клеткам. Специфичность действия гормонов определяется рецепторами, расположенными на мембранах клеток-мишеней и принимающих адресованные им сигналы, под влиянием которых происходят изменения функциональной активности управляемых клеток. Нервные клетки тоже используют химические вещества для передачи сигналов, такие вещества называются нейромедиаторами. Нейроны могут действовать только на такие клетки, которые образуют с ними функциональные соединения — синапсы, а поэтому действие медиаторов проявляется немедленно и только в синапсе. Гормоны поступают в общий кровоток и поэтому способны