Цель работы – ознакомление с основами фазового анализа, приобретение навыков работы с диаграммами состояния.
Рассмотрим конкретную диаграмму состояния полупроводниковой квазибинарной системы. Большинство двойных систем полупроводник – примесь являются системами с неограниченной растворимостью компонентов друг в друге в расплавленном состоянии и с ограниченной растворимостью – в твердом состоянии. Для этой диаграммы HgTe-SnТе (рис. 9.1) характерны: эвтектика, полная нерастворимость компонент в твердом состоянии со стороны HgTe и твердый раствор (β) с ограниченной растворимостью со стороны SnTe.
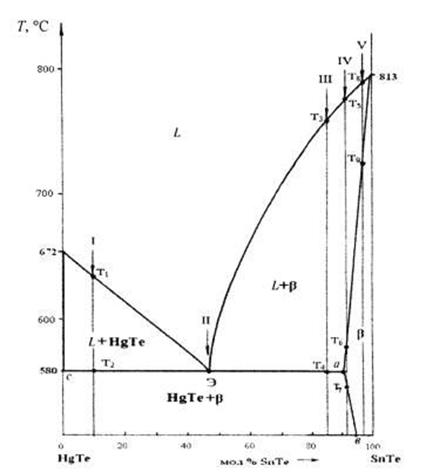
Рис. 9.1. Диаграмма состояния HgTe-SnТe
Основные фазовые области: а) однофазные – это жидкий раствор L и твердый раствор β; б) двухфазные области: (L + HgTe), (L + β), а также область существования смеси (HgTe s + β s). Линия на диаграмме, выше которой все сплавы находятся в жидком состоянии, называется линией ликвидус, а линия, ниже которой заканчивается затвердевание – линией солидус. В конкретном случае линия ликвидус: Тпл (НgТе) – Э – Тпл (SnТе), а линия солидус Тпл (НgТе) – c – а – Тпл (SnTe).
Весь диапазон составов диаграммы HgTe-SnТе можно разделить на ряд подобластей по шкале составов: доэвтектические HgTe–Э, эвтектический – Э и заэвтектические (Э- а, а - в, в -SnТе). Каждый из них отличается от других по типу превращений в процессе охлаждения и затвердевания.
Рассмотрим наиболее характерные составы.
Кристаллизация доэвтектического сплава состава I. При охлаждении исходного расплава L до точки Т1, соответствующей равновесной температуре ликвидуса, начинается образование кристаллов. Чтобы определить, какое вещество начинает выделяться, необходимо через точку Т1 провести изотерму до пересечения с линией солидус. Для сплава I эта точка пересечения изотермы с линией солидуса соответствует составу чистого компонента HgTe.
Одним из важнейших методов физико-химического исследования полупроводниковых материалов является металлографический анализ. Он позволяет выявить детали структуры, минимальные размеры которых превышают длину волны света. Исследование проводится на отшлифованных и отполированных срезах – «шлифах», протравленных полирующим и/или селективным травителем. Различный характер травления структурных составляющих приводит к появлению контраста, различимого в оптическом микроскопе по цвету, рельефу зерен и т.п. на поверхности шлифа. Этот фазовый анализ микроструктуры позволяет оценить интервал концентраций компонентов в соответствии с диаграммой состояния.
С помощью металлографического анализа решается и целый ряд количественных задач: определение доли структурной составляющей в объеме сплава, определение среднего размера частиц фазы или распределение их по размерам и др.
Фаза HgTe под микроскопом выглядит более темной, чем фаза β (рис. 9. 2). Кристаллизация протекает в интервале температур от Т1 до Т2 и заканчивается при температуре, соответствующей равновесной температуре солидуса. Происходит рост кристаллов HgTe, но состав твердой фазы не меняется. Состав жидкой фазы меняется по кривой ликвидуса и стремится к точке эвтектики. В конце кристаллизации при Тэ между кристаллами HgTe затвердевает остальная часть расплава в виде эвтектической смеси.

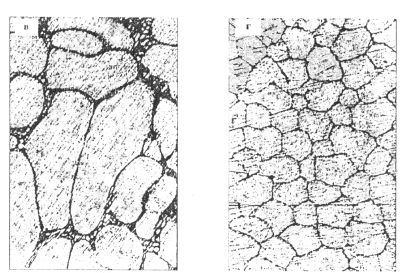
Рис. 9.2. Микроструктура доэвтектического (а), эвтектического (6) и заэвтектических (в, г) составов
Здесь наряду с понятием фаза вводится понятие структурных составляющих. Макроструктура сплава под микроскопом (рис. 9.2, а) будет представлена двумя структурными составляющими: крупными кристаллами HgTe (темные большие кристаллы на рис. 9.2, а), между которыми расположены вкрапления эвтектики (HgTe + β), которая является второй структурной составляющей.
Кристаллизация сплава эвтектического состава II (рис. 9.2, б) имеет некоторые особенности. Кристаллизация протекает при постоянной температуре, соответствующей точке эвтектики Тэ. Как видно из диаграммы, температура эвтектики является наименьшей температурой кристаллизации во всей системе.
Кристаллизация начинается с одновременного зарождения кристаллов двух твердых фаз HgTe и β и из однофазной (L) сразу становится трехфазной (L, HgTe и β). Точка Тэ для эвтектического состава является равновесной температурой ликвидуса и солидуса одновременно. Диаграмма состояния определяет состав эвтектики (47,5 % SnТе).
Охлаждение расплава L до Тэ приводит к полному затвердеванию эвтектической смеси. Эвтектика, таким образом, – система двухфазная, но представляет собой одну структурную составляющую. Микроструктура эвтектики – это мелкодисперсная однородная смесь кристаллов HgTe и β (точка а). На рис. 9.2, б структура эвтектики доминирует. Ниже Тэ эвтектическую смесь двух фаз по мере охлаждения либо не меняет состав своих компонентов для HgTe, либо для твердого раствора β меняет его по кривой а-в.
Сплав состава III (рис. 9.1) относится к заэвтектическому. Он кристаллизуется аналогично сплаву I, но отличается тем, что при охлаждении из жидкой фазы выделяются кристаллы твердого раствора β. После затвердевания на шлифе под микроскопом наблюдаются две структурные составляющие: кристаллы β (светлые образования) и эвтектика, представленная при детальном рассмотрении темными кристалликами HgTe и светлыми β (рис. 9.2, в).
Сплав состава IV (рис. 9.1) также относится к заэвтектическому. Однако при охлаждении после полного затвердевания этот состав проходит через линию вторичных превращений а-в. Рассмотрим его кристаллизацию подробнее. При охлаждении до ликвидуса T5 начинается выделение первичных кристаллов β, которые растут из жидкой фазы до Т6. При температуре Т6 происходит полное затвердевание с выделением твердого раствора, состав которого может быть охарактеризован точкой Т6. От температуры Т6 до Т7 происходит охлаждение без изменения состава β. С достижением температуры Т7, попадаем на линию вторичных превращений а-в, начинается частичный распад твердого раствора β: из пересыщенного твердого раствора выделяются вторичные кристаллы, точнее состав β изменяется по линии а-в, и при комнатной температуре соответствует точке в. Такое изменение состава твердого раствора соответствует уменьшению в нем составляющей HgTe. Она выделяется при равновесной кристаллизации из кристаллов β в виде второй фазы HgTe по границам зерен (рис. 9.2, г). Вследствие выделения новой фазы HgTe макроструктура представлена двумя структурными составляющими: в основном кристаллами β и вторичными выделениями HgTe на границах зерен.
Расплав состава V (например, 97 % SnTe на рис. 9.1) позволяет получить при комнатной температуре однофазный твердый раствор SnHgTe. Действительно, расплав начнет кристаллизоваться при температуре Т8 с выделением фазы β. До Т9 продолжается рост кристаллов β, а после этой температуры происходит лишь охлаждение кристаллов первичного твердого раствора р, который сохраняет свой состав до комнатной температуры. Под микроскопом можно обнаружить только однофазную систему.
Перитектические превращения типичны для полупроводниковых систем. При перитектическом превращении происходит образование одной новой твердой фазы при взаимодействии двух других, полностью или частично исчезающих при этом. На диаграммах перитектические превращения часто сочетаются с образованием нестойких химических соединений с «инконгруэнтным » плавлением. Рассмотрим диаграмму Si-C (рис. 9.3).
На этой диаграмме линия перитектики соответствует а-в-с, что свидетельствует о постоянной температуре превращения. Следует разделить диапазоны составов: a-в, в, в-с, поскольку превращения для них различны.
При кристаллизации состава I (диапазон составов а-в) охлаждение до температуры перитектики 2830 оC приводит к тому, что первоначально образовавшиеся кристаллы С взаимодействуют с жидкой фазой, и образуется другая твердая фаза. Это описывает перитектическая реакция L +C→ L +SiС.
Превращение происходит обычно с избытком одной из фаз, в данном случае жидкой L. Новой образующейся твердой фазой является SiC. Почему в процессе перитектического превращения уже выпавшие кристаллы С растворяются в той самой жидкой фазе, из которой они только что выделились? Это объясняется тем, что до температуры перитектики в равновесии друг с другом были только фазы L и кристаллы С, а начиная с температуры перитектики, жидкая фаза может быть в равновесии также с кристаллами SiC. Выделяясь из жидкости, кристаллы SiC изменяют ее состав так, что жидкая фаза становится ненасыщенной в отношении С. Кристаллы С начинают растворяться, возвращая L к исходному составу. Этот процесс будет про исходить до тех пор, пока не растворятся все кристаллы С или пока не исчезнет вся жидкая фаза.

Рис. 9.3. Диаграмма состояния Si-С
В итоге микроструктура перитектики может быть более сложной, чем другие многофазные структуры. Это связано с тем, что взаимодействие жидкой и кристаллической фаз протекает на поверхности кристалликов, здесь же выделяется и новая кристаллическая фаза. Реально при сравнительно быстром охлаждении процесс изменения состава обычно не протекает до конца. Кристаллы первоначально выпавшей фазы содержат вкрапления возникающей при перитектическом превращении новой фазы, и определение структуры представляет затруднения.
Дальнейшее охлаждение системы связано с ростом кристаллов SiC, и при температуре 1408 оC происходит полное затвердевание с выходом на вырожденную эвтектику. Диаграмма содержит неустойчивое химическое соединение с «инконгруэнтным» плавлением – карбид кремния. Он разлагается при температуре – 2830 oС, не достигая максимума на кривой ликвидус, который на диаграммах характеризует Тпл устойчивого соединения.
Химическое соединение SiC может быть получено, судя по диаграмме (рис. 9.3), если охлаждается расплав исходного состава II. Карбид кремния SiC образуется в этом случае по перитектической реакции L +C→ SiC. Структура такого состава после охлаждения соответствует однофазной системе.
При кристаллизации состава типа III (диапазон составов в-с) вначале выделяется твердая фаза С. При охлаждении до температуры перитектики жидкая фаза исчезает, возникают две твердые фазы: L +C→ SiC+C.
Такая замена осуществляется простым диффузионным взаимодействием кристаллов углерода и карбида кремния.
Количественное соотношение твердых фаз С и SiC определяется правилом отрезков: C/SiC = ad / dc и зависит, конечно, от выбора исходного сплава (рис. 9.3).
Превращение, аналогичное перитектическому, возможно в ряде полупроводниковых систем и после полного затвердевания как вторичное. В этом случае оно происходит с участием только твердых фаз и называется перитектоидным.
ЗАДАНИЕ
1. Проанализировать бинарные системы с эвтектикой, с вырожденной эвтектикой. Анализ диаграмм состояния сопровождать построением кривых охлаждения для наиболее характерных разрезов. По диаграмме состояния определить при заданных температурах состав фаз, находящихся в равновесии.
2. Проанализировать систему, в которой практически полностью отсутствует растворение в твердой фазе.
3. Проанализировать систему с перитектикой;
4. Проанализировать диаграмму состояния, содержащую область ограниченных твердых растворов.
5. На примере диаграмм состояния с простой эвтектикой и перитектикой показать и объяснить различие в микроструктурах образцов, равновесноохлажденных и закаленных от заданной температуры.