Широкое использование понятия эксергии в термодинамике, и в частности при термодинамическом анализе, привело к необходимости непосредственно, без специальных расчетов, находить величины е, eq и их составляющие для различных веществ и смесей, а также значения te при заданных Т и 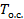 .
.
Решение этих задач, так же как и многие расчеты с эксергстическими функциями, удобно проводить графическими методами.
В некоторых случаях для этого можно использовать диаграммы состояния соответствующих веществ в координатах Т, s и особенно h, s, нанеся на них линии e =const. Однако такой метод не всегда позволяет получить все необходимые данные. Поэтому были разработаны и применяются на практике специальные диаграммы, в которых эксергетические функции используются непосредственно в качестве одной из координат, а также номограммы с эксергией е в качестве ординаты. Наиболее практически важная из таких номограмм предназначена для определения и изотермической работы сжатия различных газов в широком интервале температур и давлений [42].
Посредством эксергетических диаграмм могут быть также выявлены и наглядно представлены такие свойства и характеристики процессов, которые не могут быть получены с помощью обычных диаграмм состояния, в которые параметры окружающей среды не входят.
Рассмотрим свойства некоторых эксергетических диаграмм состояния, а также методы их использования для термодинамических расчетов низкотемпературных процессов.
б) е, h -ДИАГРАММА (ЭКСЕРГИЯ − ЭНТАЛЬПИЯ) И ЕЕ МОДИФИКАЦИИ
Диаграмма е, h представляет собой косоугольную модификацию h, s -диаграммы, где ось энтропии наклонена влево от вертикали на угол, при котором все прямые e =const располагаются горизонтально.
В зависимости от физических свойств вещества расположение его л граммы на координатной сетке е, i выглядит различно. На рис. 3-4 показан внешний вид диаграммы для двух характерных случаев.
В первом случае (рис. 3-4, а), характерном для криоагентов, нулевая точка определяется пересечением изобары р 0.с и изотермы 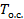 ,находящейся в области перегретого пара (газа). Поэтому область влажного пара, температура в которой значительно ниже
,находящейся в области перегретого пара (газа). Поэтому область влажного пара, температура в которой значительно ниже 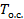 ,соответствует состояниям с высокой эксергией и перемещается в левый верхний край диа граммы.
,соответствует состояниям с высокой эксергией и перемещается в левый верхний край диа граммы.

Рис. 3-4. Внешний вид е, h -диаграммы для разных веществ.
Чем ниже критическая температура рабочего тела, тем, при прочих равных условиях, выше эксергня влажного пара и жидкости и тем выше расположена область влажного пара. Такой вид имеют диаграммы метана, воздуха, кислорода, азота, водорода, неона, гелия и др. Во втором случае (рис. 3-4, б) прямая окружающей среды совпадает с изотермой 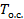 в области влажного пара. Это характерно для таких ве ществ, как вода и ряд хладоагентов с нормальной температурой кипения T нк ниже 250−260 К (в частности, аммиак и большинство фреонов). Подробный анализ свойств е, h- диаграммы дан в [5].
в области влажного пара. Это характерно для таких ве ществ, как вода и ряд хладоагентов с нормальной температурой кипения T нк ниже 250−260 К (в частности, аммиак и большинство фреонов). Подробный анализ свойств е, h- диаграммы дан в [5].
Определение составляющих величин эксергии
Диаграмма e, h позволяет определить для любого состояния вещеества составляющие эксергии потока, связанные как с разностью давлении ep, так и с разностью температур eT по отношению к окружающей среде.
Нужное для определения составляющих ер и eT построение показано на рис. 3-5. Например, для точки 1 величина  будет равна разности ординат точек 1 и 2 (точка 2 находится на пересечении изобары р 1и изотермы
будет равна разности ординат точек 1 и 2 (точка 2 находится на пересечении изобары р 1и изотермы 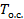 );величина
);величина  равна разности ординат точек 2 и 0.
равна разности ординат точек 2 и 0.
Все состояния, соответствующие прямой ab,имеют одинаковую эксергию e 1. Поэтому обратимый переход из любого заданного состоянии на этой прямой в другое, определяемое этой же ординатой е 1возможен без затраты работы (и без ее получения). При этом только изменяется соотношение между eT и ep; один вид эксергии, связанный с  , переходит в другой, связанный с
, переходит в другой, связанный с  или наоборот.
или наоборот.

Рис. 3-5. Графическое определение составляющих эксергии ep и eT.
В частности, в точке 1 ' значение eT =0 и e=ep. В точке 1",напротив, ep =0, а e=eT.
Взаимосвязь различных состояний с точки зрения условий перехода одного в другое наглядно иллюстрируется на e, h -диаграмме посредством простой механической аналогии.
Можно представить себе прямую, соединяющую две точки, как след плоскости, перпендикулярной плоскости диаграммы. Тогда шарик, помещённый на этой плоскости, будет скатываться в сторону возможного направления процесса. Работа, которую в этом случае можно получить от единицы массы вещества − D e, равна изменению потенциальной энергии единицы массы шарика, если рассматривать величину е как высоту, определяющую его положение.
Для состояний, расположенных на прямой ab, значение D e = 0 и шарик А может передвигаться в любую сторону без затраты или производства работы.
Если рассмотреть состояния, точки которых расположены на прямой то видно, что шарик Б может скатываться только в направлении от а к с. Это означает, что самопроизвольный переход по этой прямой возможен только вправо вниз; движение в противоположном направлении возможно только при затрате работы l (или соответствующей эксергии любого вида), в идеальном случае равной D e, в реальном – большей D e на величину потерь d.
За счет эксергии самого рабочего тела такой процесс (с движением вверх) неосуществим.
В точках 5 и 6 значения ep и eT соответственно равны по абсолютной величине и противоположны по знаку; поэтому значения e 5 и e 6 равны нулю. В точках 4 и 3 значение e <0.
Процессы перевода одного вида эксергии в другой в потоке рабочего тела широко используются в технике как в одном потоке, так и при взаимодействии нескольких потоков. Примером первого процесса могут служить дросселирование и расширение с отдачей внешней работы, используемые в низкотемпературной технике, когда за счет уменьшения ep увеличивается eT (связанная с внутренним охлаждением газа)1. Примером второго вида является процесс в эжекторе, где за счет уменьшения  одного потока возрастает
одного потока возрастает  другого потока при соответствующем изменении eT.
другого потока при соответствующем изменении eT.
Поскольку реальные процессы связаны с потерями эксергии, суммарная величина  на выходе всегда меньше, чем на входе, на величину потери d.
на выходе всегда меньше, чем на входе, на величину потери d.
1 Этот вопрос подробно рассмотрен в гл. 4.
WQ
Расчеты работы и эксергии тепла в обратимых процессах посредством е, h -диаграммы
Диаграмма е, h позволяет найти работу и некоторые другие энергетические характеристики процессов, проводимых с реальными рабочими телами1. Без использования е, h -диаграммы такие расчеты обычно требуют проведения специальных вычислений. Рассмотрим некоторые характерные примеры.
Сжатие и расширение любого рабочего тела при обратимом проведении процесса может характеризоваться энергетическим и эксергетическим балансами. Поскольку при сжатии и расширении изменяются только знаки, а уравнения остаются теми же, мы рассмотрим в качестве примера процесс сжатия, схема которого показана на рис. 3-6.
Пользуясь первым началом термодинамики и уравнением (3-3а) и принимая во внимание, что D =0 и D E= 0 (процесс обратимый и стационарный), получим следующие уравнения.
Уравнение энергетического баланса (рис. 3-6, а) для единицы массы рабочего тела:
 (3-20)
(3-20)
или
 (3-21)
(3-21)
Естественно, что все полученные ниже выводы относятся и к идеальному газу как к частному случаю.

Рис. 3-6. Энергетический и эксергетичеекий балансы процессов идеального
изотермического сжатия.
а − энергетический баланс; б− эксергетический баланс.
Уравнение эксергетического баланса (рис. 3-6, б):
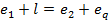
или
 (3-22)
(3-22)
В зависимости от знака 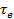 , определяемого соотношением температур Т и
, определяемого соотношением температур Т и 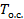 ,величина
,величина 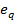 может быть как положительной, так и отрицательной. Практически наиболее интересен случай сжатия при Т=
может быть как положительной, так и отрицательной. Практически наиболее интересен случай сжатия при Т= 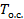 . В этом случае
. В этом случае  и
и  . Следовательно,
. Следовательно,
 (3-23)
(3-23)
т. е. работа изотермического сжатия (расширения) при температуре окружающей среды равна разности эксергий в начальном и конечном состояниях.
На рис. 3-7 показан такой изотермический процесс сжатия в координатах е, h. На практике наиболее просто определить изотермическую работу сжатия (расширения) по специальным эксергетическим номограммам, построенным для разных газов (воздуха, кислорода, аргона, in порода и гелия) [42].
Расчет работы изотермического сжатия по аналитическим формулам, особенно с учетом реальности газа, намного более трудоемок.
В научной и технической литературе часто можно встретить термин «энергия сжатого газа» и связанные с ним такие формулировки, как «использование энергии сжатого газа», «потери энергии сжатого газа» и т. д.

Рис. 3-7. Процесс изотермического сжатия при Т=  в е, h -диаграмме.
в е, h -диаграмме.
Рис. 3-8. Поверхности состояний бинарной смеси в пространстве h, e,𝜉.
Такая терминология не соответствует действительной картине энергетических превращений при сжатии ирасширении газа,поскольку энергия сжатого газа незначительно или совсем не отличается от энергии несжатого газа и в большинстве случаев меньше ее (в частности, длявоздуха) [5]. Следовательно, речь должна идти не об энергии сжатого газа, а об его эксергии, которая и определяет его работоспособность.
Точно так же неверно говорить о «потере энергии» при дросселировании газа (в клапанах, дроссельных устройствах и т. д.). В этом случае речь должнаидти о потерях эксергии,величина которыхдействительно отражает физическую сущность процесса.
В тех случаях, когда изотермическое сжатие происходит при температуре T ≠  , значение
, значение 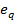 не равно нулю и работа отличается от D e [5].
не равно нулю и работа отличается от D e [5].
Диаграмма е, h позволяет определять и минимальную работу любых других процессов изменения состояния, например процессов охлаждения.
Найдем, например, пользуясь e, h -диаграммой воздуха [5, 43] величину минимальной работы, необходимой дляперевода воздуха из нулевого состояния в жидкость при р= 0,1МПа. Эксергия жидкости при р = 0,1 МПа е =702,5 кДж/кг. Следовательно, l = 702,5−0=702,5 кДж/кг.
Если бы воздух был предварительно охлажден, например до 150 К, то его эксергия в начальной точке процесса составила бы 53,5 кДж/кг. Тогда необходимая минимальная работа была бы равна

Аналогично описанным примерам, по разности эксергии можно определить минимальную (или максимальную) работу перехода вещества из любого заданного состояния в другое. е, h -диаграмма дает возможность производить также и расчеты, связанные с теплообменом (гл. 4).
Пользуясь зависимостью (3-19) между эксергией тепла 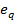 и разностью эксергии в изобарном процессе, можно найти
и разностью эксергии в изобарном процессе, можно найти 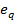 для любого изменения состояния при p =const. Найдем, например, эксергию теплового потока, который нужно отвести от потока воздуха при р =6,0 МПа, чтобы охладить его от 300 до 160 К. Эксергия воздуха при 300 К и 6,0 МПа e 1=343 кДж/кг и при 160 К e 2=409 кДж/кг. Следовательно,
для любого изменения состояния при p =const. Найдем, например, эксергию теплового потока, который нужно отвести от потока воздуха при р =6,0 МПа, чтобы охладить его от 300 до 160 К. Эксергия воздуха при 300 К и 6,0 МПа e 1=343 кДж/кг и при 160 К e 2=409 кДж/кг. Следовательно,  . Количество тепла, отводимого от газа, равно разности энтальпий
. Количество тепла, отводимого от газа, равно разности энтальпий  кДж/кг. Таким образом, отводу тепла от рабочего тела при T <
кДж/кг. Таким образом, отводу тепла от рабочего тела при T < 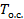 соответствует подвод эксергии.
соответствует подвод эксергии.
в)  ДИАГРАММА (ЭКСЕРГИЯ −КОНЦЕНТРАЦИЯ)
ДИАГРАММА (ЭКСЕРГИЯ −КОНЦЕНТРАЦИЯ)
В низкотемпературной технике часто приходится встречаться с разделением смесей, в частности двухкомпопентных (бинарных). Процессы с двухкомпонептными смесями обычно исследуются посредством
I  -диаграммы (энтальпия − концентрация) и
-диаграммы (энтальпия − концентрация) и  -диаграммы (энтропия− концентрация); последняя позволяет находить лриращеняя эн-ропии, а по ним − работу разделения и потери от необратимости. Эк-п'ргетические диаграммы позволяют определять и эксергии компонентов смеси и работу разделения непосредственно.
-диаграммы (энтропия− концентрация); последняя позволяет находить лриращеняя эн-ропии, а по ним − работу разделения и потери от необратимости. Эк-п'ргетические диаграммы позволяют определять и эксергии компонентов смеси и работу разделения непосредственно.
Для этого необходимо располагать значениями е не только для различных давлений и температур, но и в зависимости от концентрации. Соответствующая эксергетическая диаграмма должна отличаться от е9 /-диаграммы наличием третьей координаты ^-концентрации1.
Состояние смеси будет при этом отображаться точками в пространстве  . Условиям фазовых переходов (х=0 и х=1, где х − влажность пара), а также p=const и r=const будут соответствовать определенные поверхности. Линии пересечения этих поверхностей с плоскостью
. Условиям фазовых переходов (х=0 и х=1, где х − влажность пара), а также p=const и r=const будут соответствовать определенные поверхности. Линии пересечения этих поверхностей с плоскостью  дадут е, г-диатрамму для смеси соответствующего состава.
дадут е, г-диатрамму для смеси соответствующего состава.
При  получится е> /-диаграмма чистого вещества В, при
получится е> /-диаграмма чистого вещества В, при  −
−
чистого вещества А (рис. 3-8),
1 Для смеси, состоящей из легкокипящего компонента А и тяжелокипящего Ву личина  показывает мольную концентрацию легкокипящего компонента Л.
показывает мольную концентрацию легкокипящего компонента Л.
Рис. 3-9. Схема  -диаграммы для давления ро.с
-диаграммы для давления ро.с
Рис. 3-10. Влияние изменения давления на положение изотерм в диаграмме.

Проекции линий пересечений поверхностей 7*=const дают на плоскостях и s- и  -диаграммы для данных давлений р.
-диаграммы для данных давлений р.
Диаграмма  широко известна и применяется в расчетах с бинарными смесями. Диаграмма
широко известна и применяется в расчетах с бинарными смесями. Диаграмма  _ используется для термодинамического анализа процессов с бинарными смесями, так же как и е, i-диаграмма для процессов с чистым веществом.
_ используется для термодинамического анализа процессов с бинарными смесями, так же как и е, i-диаграмма для процессов с чистым веществом.
На рис. 3-9 показана схема  -диаграммы для давления р=р0.с.
-диаграммы для давления р=р0.с.
По внешнему виду  -диаграмма напоминает
-диаграмма напоминает  -диаграмму, но для вещества с
-диаграмму, но для вещества с  пограничные кривые в области влажного пара,
пограничные кривые в области влажного пара,
так же как и изотермы при  , расположены в обратном порядке:
, расположены в обратном порядке:
изотермы, относящиеся к более низким температурам, находятся выше. Это объясняется тем, что е при  и p=const растет в низкотемпе-
и p=const растет в низкотемпе-
ратурной области по мере понижения энтальпии (как это видно и из i, е-диаграммы чистого вещества при p=const). В области  изо-
изо-
термы также расположены выше изотермы 70.с, но эксергия в этой области растет с температурой. Во всех случаях соблюдается одно и то же правило; чем больше отличается температура от Т0.с> тем дальше расположена рассматриваемая изотерма от изотермы Г0.с.
Концентрация  соответствует составу разделяемой смеси. Для
соответствует составу разделяемой смеси. Для
воздуха,  рассматриваемого как бинарная смесь кислорода и азота,. Точка ос нулевой эксергией соответствует давлению р0.с и температуре Го.с. Для других смесей выбор точки о определяется, как указывалось выше, составом разделяемой смеси и параметрами р0.с и Го.с-
рассматриваемого как бинарная смесь кислорода и азота,. Точка ос нулевой эксергией соответствует давлению р0.с и температуре Го.с. Для других смесей выбор точки о определяется, как указывалось выше, составом разделяемой смеси и параметрами р0.с и Го.с-
Все изотермы на  -диаграмме обращены выпуклостью вниз, так как эксергия чистых компонентов выше эксергии смесей на величину минимальной работы разделения.
-диаграмме обращены выпуклостью вниз, так как эксергия чистых компонентов выше эксергии смесей на величину минимальной работы разделения.
В верхней части диаграммы находится область влажного пара, причем линия х=0 лежит выше, чем линия х=\. Это объясняется большим значением эксергии жидкости для любой данной  , чем сухого насыщенного пара. В области влажного пара изотермы представляют собой наклонные прямые, причем угол их наклона изменяется по мере приближения к линиям
, чем сухого насыщенного пара. В области влажного пара изотермы представляют собой наклонные прямые, причем угол их наклона изменяется по мере приближения к линиям  и
и  , где изотермы вертикальны, как и в
, где изотермы вертикальны, как и в  -диаграмме.
-диаграмме.
При давлении р<р0.с (вакуум) изотерма Г0.с опускается частично или полностью под прямую <? = 0, в область е<0. Соответственно смещаются вниз и другие изотермы. Границы области влажного пара при этом раздвигаются вследствие увеличения разности е при х==0 и х*=1 для всех значений концентраций (рис. 3-10). При давлении р>ро.с изотермы смещаются вверх, а область влажного пара сужается.
На  -диаграмму можно нанести изотермы и пограничные кривые для любых нужных давлений. Тогда, пользуясь свойствами эксергети- ческой диаграммы, можно определить минимальную работу разделения для любых состояний продуктов разделения, с учетом их температур и давлений. Действительно, работа разделения равна сумме работ изотер*
-диаграмму можно нанести изотермы и пограничные кривые для любых нужных давлений. Тогда, пользуясь свойствами эксергети- ческой диаграммы, можно определить минимальную работу разделения для любых состояний продуктов разделения, с учетом их температур и давлений. Действительно, работа разделения равна сумме работ изотер*
мического сжатия компонентов от их парциальных давлений pi до исходного давления смеси р. (Для иеидеальных смесей в выражение для минимальной работы разделения смеси идеальных газов при Т0.с и р0.с следует вместо парциального давления подставлять летучесть соответствующих компонентов). Каждая из полученных при расчете работ равна соответствующей величине  , которую легко найти на
, которую легко найти на  -диаграмме путем простого построения.
-диаграмме путем простого построения.
Таким образом, посредством  -диаграммы можно находить минимальную работу процессов, включающих одновременно как разделение-смеси, так и изменение любых параметров исходной смеси и продуктов разделения.
-диаграммы можно находить минимальную работу процессов, включающих одновременно как разделение-смеси, так и изменение любых параметров исходной смеси и продуктов разделения.
Подробно свойства  -диаграммы и методика расчетов с ее ис-
-диаграммы и методика расчетов с ее ис-
пользованием изложены в [5].
г)  -ДИАГРАММА (ЭНТАЛЬПИЯ − ЭКСЕРГЕТИЧЕСКАЯ ТЕМПЕРАТУРА)
-ДИАГРАММА (ЭНТАЛЬПИЯ − ЭКСЕРГЕТИЧЕСКАЯ ТЕМПЕРАТУРА)
Диаграмма  представляет собой модификацию U ^-диаграммы,,
представляет собой модификацию U ^-диаграммы,,
широко применяемой в низкотемпературной технике. Разница между этими диаграммами состоит в том, что по оси ординат откладывается не температура (К), а величины функции  . Так как каждому значению Т соответствует при данном Т0.с определенное значение
. Так как каждому значению Т соответствует при данном Т0.с определенное значение  , то изотермы на
, то изотермы на 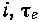 -диаграмме проходят горизонтально.
-диаграмме проходят горизонтально.
Диаграмма 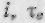 позволяет проводить расчеты, связанные с эксер-
позволяет проводить расчеты, связанные с эксер-
гией теплового потока  . Значение эксергии теплового потока
. Значение эксергии теплового потока  = =
= =  , связанного с изобарным изменением состояния, изображается
, связанного с изобарным изменением состояния, изображается
па 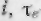 -диаграмме заштрихованной площадью (рис. 3-11). Действительно, в элементарном изобарном процессе аЬ отрезок оси абсцисс di равен элементарному количеству тепла, отданному или полученному телом. Поэтому площадь элементарной площадки abed, высота которой равна те, численно равна
-диаграмме заштрихованной площадью (рис. 3-11). Действительно, в элементарном изобарном процессе аЬ отрезок оси абсцисс di равен элементарному количеству тепла, отданному или полученному телом. Поэтому площадь элементарной площадки abed, высота которой равна те, численно равна 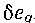 _, Соответственно для всего процесса 1-2 площадь
_, Соответственно для всего процесса 1-2 площадь  равна:
равна: 
В расчетной практике и при термодинамическом анализе наибольшее распространение получили графики в  -координатах, в которых использованы свойства
-координатах, в которых использованы свойства  -диаграммы, описанные выше. Основным отличием такого графика от
-диаграммы, описанные выше. Основным отличием такого графика от  -диаграммы является то, что по оси абсцисс откладывается не параметр состояния £, а параметр процесса», сопровождающегося передачей эксергии в форме тепла q. Поэтому диаграмма становится пригодной для изучения процессов теплообмена, где количества и составы веществ, участвующих в процессах, различны и величина i одного вещества недостаточна для тепловой характеристики процесса. На графике можно наносить кривые, характеризующие изменение температуры и тепловые потоки разных веществ при разных количествах их в потоках, q, тс-диаграмма может использоваться для графического анализа процессов теплообмена. Способ изображения
-диаграммы является то, что по оси абсцисс откладывается не параметр состояния £, а параметр процесса», сопровождающегося передачей эксергии в форме тепла q. Поэтому диаграмма становится пригодной для изучения процессов теплообмена, где количества и составы веществ, участвующих в процессах, различны и величина i одного вещества недостаточна для тепловой характеристики процесса. На графике можно наносить кривые, характеризующие изменение температуры и тепловые потоки разных веществ при разных количествах их в потоках, q, тс-диаграмма может использоваться для графического анализа процессов теплообмена. Способ изображения
эксергии тепла на  -диаграмме ничем не отличается от описанного
-диаграмме ничем не отличается от описанного
выше для 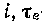 -диаграммы. Это позволяет наглядно изобразить изменение эксергии тепла при теплообмене.
-диаграммы. Это позволяет наглядно изобразить изменение эксергии тепла при теплообмене.
Рассмотрим для примера теплообменник, работающий при температурах ниже То.с- Откладывая по оси q на  -диаграмме количество тепла, переданное в данном теплообменнике (отрезок
-диаграмме количество тепла, переданное в данном теплообменнике (отрезок  на рис. 3-12), а на вертикальных линиях, проходящих через эти точки, − значения те, получим кривые, показывающие изменение температуры каждого из потоков по мере отвода или подвода тепла *.
на рис. 3-12), а на вертикальных линиях, проходящих через эти точки, − значения те, получим кривые, показывающие изменение температуры каждого из потоков по мере отвода или подвода тепла *.
Охлаждаемому телу А будет соответствовать кривая 1-2, нагреваемому В − кривая 3-4. Так как во всех сечениях теплообменника имеется конечная разность температур, то кривая 3-4 везде будет проходить ниже кривой 1-2. По смыслу диаграмм i,xe или q,xe, площадь a-S-4-b − отрицательна и соответствует эксергии, отведенной от тела В. Площадь l-2-a-b положительна и равна эксергии, полученной телом А. Разность между ними − площадь 1-2-3-4 − равна эксергии d, потерянной при теплопередаче.
Таким образом,  -диаграмма позволяет показать численное зна-
-диаграмма позволяет показать численное зна-
чение потерь от необратимости при теплообмене и распределение их вдоль аппарата.
1 Точки для построения этих кривых удобнее всего брать с  • или t, Г-диаграм-мы соответствующего вещества.
• или t, Г-диаграм-мы соответствующего вещества.
Рис. 3-11. Величина эксергии теплового потока на  -диаграмме.
-диаграмме.
Рис. 3-12. Определение потерь в процессе теплообмена по  -диаграмме.
-диаграмме.
