Аминокислоты, из которых состоят белки, являются L-a-амино-или иминокислотами. Мы привыкли считать аминокислоты структурными элементами белков, но они находят применение как пищевые добавки, приправы, усилители вкуса, как сырье для изготовления парфюмерной и фармацевтической продукции и при производстве других веществ. Их можно получать как из природных продуктов (главным образом при гидролизе белков растений), так и путем химического, микробиологического или ферментативного синтеза. Если химический синтез дает рацемат, который требует дальнейшей обработки, то последние два метода позволяют получить оптические чистые аминокислоты.
Основным условием протекания большинства производственных процессов с участием микроорганизмов является изменение условий среды: именно за счет этого достигается синтез избыточных количеств желаемого продукта. Дисбаланса в метаболизме можно добиться путем эмпирического изменения таких факторов, как концентрация субстрата, рН, концентрация продукта, или же путем установления критических уровней содержания других веществ (ионов металлов, органических добавок) в среде. Для получения больших количеств были выработаны новые способы изменений метаболизма у организмов-продуцентов, направленных на увеличение выхода промежуточных продуктов, образование которых в иных условиях находится под строгим метаболическим контролем.
Для производства аминокислот бактерии стали использоваться с начала 50-х гг. XX в. Свойства штаммов постоянно улучшали генетическими методами, выделяя ауксотрофиые мутанты и мутанты с измененными регуляториыми свойствами. Чтобы обеспечить образование аминокислот в больших количествах, в любом случае необходимо изменить систему регуляции обмена. Для этого можно либо стимулировать потребление субстрата в некоторых путях биосинтеза и выделение аминокислот в среду, либо подавить побочные реакции и процессы деградации аминокислот.
Производство L-глутамата, L-валина, 1),1.-аланипа, L-глутамина и L-пролииа при участии диких штаммов бактерий основано либо на
использовании присущих последним особенностей метаболизма, либо на стимуляции образования аминокислот в ответ на изменение условий внешней среды. На это способны бактерии многих родов (например, Corynebacterium, Brevibacterium, Bacillus, Aerobacter, Micro-bacterium, Escherichia), причем они настолько продуктивны, что производство становится рентабельным. Так, виды Corynebacterium или Brevibacterium, выращиваемые на углеводном сырье (гидролизат крахмала, мелассы из сахарного тростника и свеклы), на этаноле или ацетате при наличии достаточного количества биотина в среде способны синтезировать до 30 г/л глутамата. Для накопления этой аминокислоты важным условием является полное или частичное подавление активности а-кетоглутаратдегидрогеназы. Образование продукта увеличивается при добавлении Р-лактамных антибиотиков (пенициллина, цефалоспорина С), поверхностно-активных веществ и жирных кислот. Влияние двух последних агентов обусловлено увеличением проницаемости клеточных мембран для глутамата, которая зависит от внутриклеточной концентрации жирных кислот и липидов. Путем изменения условий среды процесс ферментации, в ходе которого получается L-глутамат, может быть переключен на синтез L-глутамина или L-пролина. При высокой концентрации биотина и ионов аммония создаются благоприятные условия для образования L-пролина, а при больших концентрациях аммония и ионов цинка в слабо кислой среде усиливается синтез L-глутамина. Л^-аланин, видимо, образуется в реакции трансаминирования при участии пиру вата, затем он подвергается рацемизации ферментом аланинрацемазой.
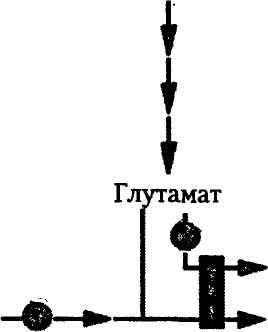
Ауксотрофные мутанты не могут образовывать ингибиторы соответствующего метаболического пути, работающие по принципу отрицательной обратной связи, так как у них отсутствует определенная ключевая ферментативная реакция. Поэтому при выращивании му-тантного штамма в среде с минимальной концентрацией необходимого питательного ингредиента они способны образовывать избыточные количества вещества-предшественника или близких к нему метаболитов блокированного пути. Так, на первом этапе в цепи биосинтеза L-аргинина у Corynebacterium glutamicum ингибирование происходит по механизму обратной связи самим конечным продуктом, и образование соответствующих ферментов подавляется им же (рис. 11). У цитруллинового ауксотрофа этой бактерии отсутствует фермент, называемый орнитинкарбамоилтрансферазой, который катализирует превращение орнитина в цитруллин на одном из промежуточных этапов биосинтеза L-аргинина. Синтез аргинина не идет, что приводит к снятию ингибирования по принципу обратной связи со всех ферментов этого пути и накоплению избытка орнитина. Ауксотрофные мутанты находят применение и в тех случаях, когда необходимо синтезировать соединения, являющиеся конечными продуктами разветвленных цепей метаболических реакций. Так, L-аспартат является общим предшественником для L-лизина, L-треонина, L-метионина и L-изо-
лейцина. Первая реакция в процессе образования всех этих аминокислот катализируется аспартокиназой, активность которой может быть ингибирована по механизму обратной связи при совместном действии L -лизина и L -треонина. У мутантов, ауксотрофных по гомосерину или треонину/метионину, существенно снижается внутриклеточная концентрация L -треонина, что снимает блокаду с аспартокиназы и позволяет клеткам накапливать L -лизин.
|
Глюкоза
АТФ
|
| Перенос ацетильной группы |
| АДФ |
N-Ацетил глута-мат
| Глутамат N-Ацетилорнитш а-Кетоглутарат |
| Глутамат
1 |
N-ацетилглутамилфосфат
| Орнитин |
| карбамоилфосфат (орнитин-карбамоилтрансфераза) |
N-Ацетил глутамат семиальдегид

|
Цетруллин
Аспартат, ATP
Аргининсукцинат" w-n. ■*• Аргинин
Фумарат
Ингибирование аргинином по механизму обратной связи
Репрессия аргинином по механизму обратной связи
Рис. 11. Биосинтез 1-аргинина
Получить ауксотрофные мутанты, способные накапливать конечные продукты неразветвленных цепей биосинтеза, например L -аргинин, невозможно. В таких случаях приходится отбирать те из них, у которых частично нарушена регуляция биосинтеза, что позволяет получить повышенный выход конечного продукта. Такие мутанты известны как регуляторные; их отбирают по устойчивости к аналогам аминокислот или же среди ревертантов ауксотрофов. В основе использования первых лежит их сходство с природными аминокислотами. Они ингибируют рост бактерий, но этот эффект может быть уменьшен путем добавления соответствующей природной аминокислоты. Таким образом, аналоги выступают в роли искусственных, работающих по принципу обратной связи ингибиторов ферментов, обеспечивающих биосинтез природных аминокислот, и одновременно подавляют процесс их включения в белки. Появление мутантов, устойчивых к ним, означает, что регуляторные ферменты соответствующего пути обмена становятся у них нечувствительными к аналогу. Так, серосодержащий аналог лизина 5-(2-аминоэтил)-1-цистеин является у Brevi-bacterium flavum ложным, действующим по принципу обратной связи ингибитором аспартокиназы. Устойчивые к его действию мутанты вырабатывают фермент, который в 150 раз менее чувствителен к ингиби-рованию по механизму обратной связи, чем фермент исходного штамма, и в результате продуцируют до 33 г/л лизина. Для увеличения выхода можно воспользоваться как ауксотрофией, так и дефектами регуляции одновременно. Так, у Corynebacterium glutamicum и Brevibacterium flavum сверхпродукции L -треонина не наблюдается, поскольку происходит сочетанное ингибирование по механизму обратной связи аспартокиназы и L -треонином, и L -лизином, a L -треонин ингибирует и гомосериндегидрогеназу. Мутант, устойчивый к аналогу треонина, а-амино-а-оксивалериановой кислоте, синтезирует в избыточном количестве треонин, так как ферменты его, ингибированные этой аминокислотой, десенсибилизированы. Принимающие участие в синтезе треонина гомосериндегидрогеназа и киназа также ингибиру-ются L-метионином, и поэтому ауксотрофы по метионину образуют L -треонин с еще большим выходом.
Регуляторные мутанты можно получить путем трансдукции, проводя при этом отбор отдельных мутаций, вызывающих полное рассогласование регуляторных механизмов, а затем объединяя эти признаки путем котрансдукции. Таким способом у одного штамма последовательно может быть закреплена устойчивость к нескольким аналогам.